Bộ đề thi Hóa 10 học kì 1 năm 2021 (Có đáp án) Phần 1
Kì thi học kì 1 sắp tới, nhu cầu tìm kiếm nguồn tài liệu ôn thi chính thống có lời giải chi tiết của các em học sinh là vô cùng lớn. Thấu hiểu điều đó, chúng tôi đã dày công sưu tầm Bộ đề thi học kì 1 Hóa 10 năm 2021 (Có đáp án) Phần 1 với nội dung được đánh giá có cấu trúc chung của đề thi cuối kì trên toàn quốc, hỗ trợ các em làm quen với cấu trúc đề thi môn Hóa học lớp 10 cùng nội dung kiến thức thường xuất hiện. Mời các em cùng quý thầy cô theo dõi bộ đề tại đây.
Đề thi Hóa học kì 1 lớp 10 năm 2021 - Đề số 1
Phần I: Trắc nghiệm
Câu 1: Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. Proton và electron.
B. Proton và nơtron.
C. Proton, nơtron và electron.
D. Nơtron và electron.
Câu 2: Nguyên tố X thuộc chu kỳ 3, nhóm IVA trong bảng tuần hoàn. Cấu hình electron nguyên tử của X là:
A. 1s22s22p63s23p4
B. 1s22s22p63s23p2
C. 1s22s22p63s23p63d104s24p2
D. 1s22s22p63s23p6
Câu 3: Hợp chất X tạo ra oxit cao nhất có công thức là AO2.Trong hợp chất khí với hiđro A chiếm 75% về khối lượng. Nguyên tố A là:
A. C (M = 12)
B. Si (M = 28)
C. S (M = 32)
D. Cl (M = 35,5)
Câu 4: Nguyên tử của các nguyên tố thuộc chu kì 5 có số lớp electron là:
A. 3
B. 4
C. 5
D. 6
Câu 5: Các nguyên tố 16X, 13Y, 9Z, 8T xếp theo thứ tự tính phi kim tăng dần là:
A. Y, X, Z, T
B. Y, X, T, Z.
C. Y, T, Z, X.
D. X, T, Y, Z.
Câu 6: Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 10 ml nước (biết trong nước chỉ có đồng vị 1H và 2H; khối lượng riêng của nước là 1 g/ml).
A. 5,35. 1020
B. 5,35. 1021
C. 5,35. 1022
D. 5,35. 1023
Câu 7: Chọn cấu hình electron đúng của ion Fe3+ (Z = 26)
A. 1s22s22p63s23p63d5
B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p63d64s2
D. 1s22s22p63s23p63d34s2
Câu 8: Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro ở đktc. Hai kim loại đó là (Biết Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133).
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Câu 9: Trong tự nhiên Bo có 2 đồng vị là 11B (81%) và 10B (19%). Nguyên tử khối trung bình của Bo là:
A. 81
B. 19
C. 10,18
D. 10,81
Câu 10: Hợp chất A được tạo thành từ ion M+ và ion X2- (được tạo ra từ các nguyên tố M và X tương ứng). Trong phân tử A có tổng số các hạt cơ bản là 92, trong đó số hạt mang điện bằng 65,22% tổng số hạt. Số khối của M lớn hơn của X là 7. Nguyên tố M là:
A. Li
B. Na
C. K
D. H
Câu 11: Chất nào sau đây chỉ chứa các liên kết cộng hóa trị?
A. CaCl2.
B. Na2O
C. KCl
D. H2S
Câu 12: Cho dãy chất sau: NH3 , N2O , N2 , HNO3. Số oxi hóa của nitơ trong các chất lần lượt là:
A. -3, 0, +1, +5
B. +3, +1, 0, +6
C. -3, +1, 0, +5
D. -3, +1, +2, +5
Phần II: Tự Luận
Câu 1: (1 điểm)
Nguyên tử của một nguyên tố X có tổng số hạt cơ bản là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tìm số p, e, n và số khối của nguyên tử nguyên tố X.
Câu 2: (3 điểm)
a/ Viết cấu hình e nguyên tử của các nguyên tố X, Y, T, Q trong các trường hợp sau: (1 điểm)
- X có Z = 20.
- Nguyên tử Y có tổng số electron trên phân lớp p là 9.
- Q có Z = 29.
- T có cấu hình electron ion T2-: 1s22s22p6.
b/ Xác định vị trí của nguyên tố X, Q trong bảng tuần hoàn. Giải thích. (1 điểm)
c/ Nêu tính chất hóa học cơ bản của nguyên tố X, Y. Giải thích. (1 điểm).
Câu 3: (3 điểm)
Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
a/ Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A. (1,5 điểm)
b/ Tính nồng độ phần trăm của các chất trong dung dịch B. (1 điểm)
c/ Nhỏ từ từ dung dịch KOH 15% vào dung dịch B đến khi thu được kết tủa có khối lượng không đổi, lọc lấy kết tủa đem nung ngoài không khí được m gam chất rắn. Tính khối lượng dung dịch KOH và m? (0,5 điểm)
(Cho M của các nguyên tố: Al = 27, Fe = 56, O = 16, H = 1, Cl = 35,5)
Đáp án đề kiểm tra Hóa 10 học kì 1 năm 2021 - Đề số 1
Phần I: Trắc nghiệm
Câu 1. C
Các hạt cấu tạo nên hầu hết các nguyên tử là proton, nơtron và electron.
Câu 2. B
X ở chu kỳ 3 nên X có 3 lớp electron; X thuộc nhóm IVA nên X có 4 electron lớp ngoài cùng. Cấu hình electron của nguyên tử X là: 1s22s22p63s23p2
Câu 3. A
Hợp chất khí với H của A có dạng AH4. Theo bài ra ta có:
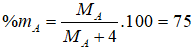
→ MA = 12. Vậy A là Cacbon.
Câu 4. C
STT chu kỳ = số lớp electron.
Câu 5. B
Z và T thuộc cùng chu kỳ, có ZZ > ZT → tính phi kim Z > T.
X và Y thuộc cùng chu kỳ, có ZX > ZY → tính phi kim X > Y.
T và X thuộc cùng nhóm, có ZX > ZT → tính phi kim của T > X.
Chiều tăng tính phi kim là: Y < X < T < Z.
Câu 6. B
Gọi % số nguyên tử của hai đồng vị 1H và 2H lần lượt là x và y
Ta có x + y = 100.
Ta lại có:
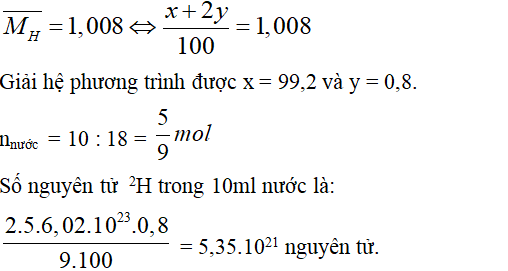
Câu 7. A
Cấu hình electron của Fe là: 1s22s22p63s23p63d64s2
→ Cấu hình electron của Fe3+ là 1s22s22p63s23p63d5
Câu 8. A

Câu 9. D
Nguyên tử khối trung bình của Bo là:
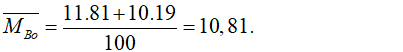
Câu 10. B
Hợp chất A có dạng: M2X
Gọi các hạt proton, nơtron và electron của M trong A lần lượt là pM, nM và eM.
các hạt proton, nơtron và electron của X trong A lần lượt là pX, nX và eX.
Tổng các hạt cơ bản trong A bằng 92
→ 4pM + 2nM + 2pX + nX = 92 (1)
Trong A, số hạt mang điện bằng 65,22% tổng số hạt nên:
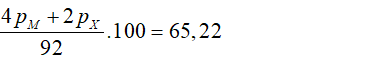
→ 2pM + PX = 30 (2)
Thay (2) vào (1) được 2nM + nX = 32 (3)
Số khối của M lớn hơn số khối của X là 7
→ pM + nM – pX – nX = 7 (4).
Lấy (2) + (3) – (4) ta được: pM + nM = 23.
Vậy M là Na.
Câu 11. D
H2S tạo nên từ hai nguyên tố phi kim → phân tử chứa liên kết cộng hóa trị.
Câu 12. C
Số oxi hóa của N trong NH3, N2O , N2 , HNO3 lần lượt là -3, +1, 0, +5.
Phần II: Tự luận
Câu 1: (1 điểm)
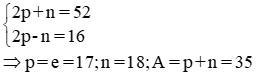
Câu 2: (3 điểm)
a) Cấu hình electron nguyên tử: (1 điểm)
X (Z = 20): 1s22s22p63s23p64s2
Y: 1s22s22p63s23p3
Q (Z = 29): 1s22s22p63s23p63d104s1
T: 1s22s22p4
b) Vị trí của X, Q trong bảng tuần hoàn: (1 điểm)
X: - Ô: 20 (vì Z = 20)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
Q: - Ô: 29 (vì Z = 29)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IB (vì là nguyên tố d và có 1 electron hoá trị)
c) Tính chất: (1 điểm)
* X - là kim loại vì có 2e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là II, Hoá trị trong hợp chất khí với hiđro: không có vì là kim loại
- Công thức oxit cao nhất XO ⇒ là oxit bazo; CT hiđroxit tương ứng X(OH)2
⇒ là bazo
* Y - là phi kim vì có 5e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là V, Hoá trị trong hợp chất khí với hiđro là III
- Công thức oxit cao nhất X2O5 ⇒ là oxit axit; CT hiđroxit tương ứng H3XO4
⇒ là axit
- CT hợp chất khí với hiđro là YH3.
Câu 3: (3 điểm)
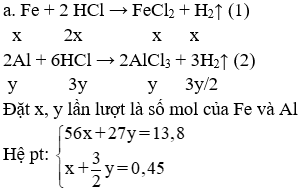
Đặt x, y lần lượt là số mol của Fe và Al
Hệ pt:
Giải hệ được: x = 0,15 mol; y = 0,2 mol
⇒ %Fe = 60,87% và %Al = 39,13%
b. Dd sau phản ứng gồm: FeCl2 0,15 mol; AlCl3 0,2 mol; HCl dư: 1,2 - (2x + 3y) = 0,3 mol
mdd B = mA + mdd HCl – mH2 = 13,8 + 750.1,1 – 0,45.2 = 837,9g
C%FeCl2 = 2,27%; C%AlCl3 = 3,19%; C%HCl = 1,31%
c. PTHH:
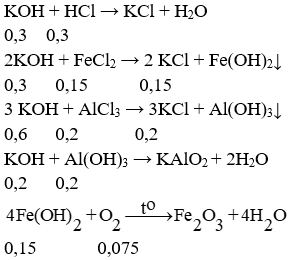
Để lượng kết tủa không đổi thì KOH cần vừa đủ để hoà tan hết Al(OH)3
⇒ Tổng số mol KOH là: 0,3 + 0,3 + 0,6 + 0,2 = 1,4 mol
⇒ Khối lượng dung dịch KOH là: (1,4.56.100) : 15 = 522,67 gam.
⇒ mrắn = 0,075.160 = 12 gam.
Đề kiểm tra Hoá 10 học kì 1 năm 2021 - Đề số 2
I. Phần trắc nghiệm:
Câu 1: Cho phản ứng: Mg + H2SO4 → MgSO4 + H2S + H2O. Tồng hệ số cân bằng là:
A. 18
B. 19
C. 20
D. 16
Câu 2. Cho Al + H2SO4 → Al2(SO4)3 + SO2 + H2O. Tổng hệ số các chất tham gia phản ứng là:
A. 6
B. 8
C. 4
D. 10
Câu 3. Cho 11,2 gam Fe + HNO3 thu được khí X có thể tích 13,44 lít. Khí X là:
A. N2
B. NO2
C. NO
D. N2O
Câu 4. Cho 9,6 gam Mg tác dụng với H2SO4 thu được 0,1 mol khí X. Khí X là:
A. S
B. SO2
C. H2S
D. SO3
Câu 5. Cho 5,4 gam Al tác dụng với H2SO4 đặc, nóng thoát ra 6,72 lít khí X (đktc). Tổng hệ số cân bằng của phản ứng là:
A. 18
B. 20
C. 11
D. 18
Câu 6. Cho Al + HNO3 thu được hỗn hợp hai khí N2 và NO tỉ lệ mol 1:1. Tổng hệ số cân bằng của HNO3
A. 63
B, 104
C.102
D. 98
Câu 7. Cho Zn tác dụng với HNO3 thu được hỗn hợp gồm N2O và NO theo tỉ lệ thể tích là 2:3. Tổng hệ số của phản ứng là:
A. 62
B. 58
C. 64
D. 80
Câu 8. Cho m gam Zn tác dụng với HNO3 thu được 6,72 lít khí N2O. m có giá trị là:
A. 16,5
B. 7,8
C. 13,5
D. 26.5
Câu 9. Cho m gam Al tác dụng với H2SO4 thu được 13.44 lit khí H2S. m có giá trị là:
A. 32.2
B. 43.2
C. 44.2
D. 65.2
Câu 10. Cho 19.2 gam Cu tác dụng với HNO3 được V lít khí NO. Khối lượng của dung dịch sau phản ứng tăng hay giảm bao nhiêu gam:
A. tăng 13.2 gam
B. giảm 13.2 gam
C. tăng 19,2 gam
D. không thay đổi.
Câu 11. Cho 8,3 gam Al và Fe tác dụng với HNO3 thu được 13.44 lít khí NO2 (đktc). Xác định %Al trong hỗn hợp.
A. 35.5%
B. 32.53%
C. 67.17%
D. 56.15%
Câu 12. Cho 7,8 gam hỗn hợp gồm Al và Mg tác dụng với H2SO4 thu được 8,96 lít khí SO2 (đktc). Tỉ lệ khối lượng của Al và Mg là
A. 9/3
B. 9/4
C. 27/24
D. 54/19
Câu 13. Cho hỗn hợp m gam Al và Cu (có tỉ lệ mol tương ứng là 1:2) tác dụng với HNO3 thu được 1.568 lít khí N2. Giá trị m là?
A. 13,2
B. 15.5
C. 16.8
D.16.5
Câu 14. Cho MnO2 + HCl → MnCl2 + Cl2 + H2O. Số phân tử HCl đóng vai trò môi trường:
A. 1
B. 4
C. 2
D. 3
Câu 15. Cho Mg + HNO3 → Mg(NO3)2 + N2 + H2O. Tỉ lệ số phân tử HNO3 đóng vai trò môi trường và bị khử là:
A. 5:1
B. 1:5
C. 12:5
D. 12:5
Câu 16. Mg + H2SO4 → MgSO4 + S + H2O. Tìm số phân tử H2SO4 bị khử và môi trường.
A. 3, 8
B. 2,7
C. 1,3
D. 2,5
Câu 18. P + HNO3 + H2O → H3PO4 + NO. Số phân tử HNO3 bị khử và môi trường là:
A. 5,0
B. 4,0
C. 6,5
D. 6,4
Câu 19. Cho 5,4 gam Al tác dụng với HNO3 thoát ra khí NO2. Tính số mol HNO3 đóng vai trò môi trường:
A. 0,6
B. 0,2
C. 0,8
D. 0,5
Câu 20. Sơ đồ nào sau đây viết sai:
A. Al → Al3+ + 3e
B. Fe3+ +1e → Fe2+
C. O2 + 2e → 2O2-
D. Cl2 + 2e → 2Cl-
Câu 21. Cho Al → Al3+ + 3e. Đi từ 13,5 gam Al, sẽ có bao nhiêu mol e được tách ra.
A. 0.5
B. 0.25
C. 1.5
D. 1.7
Câu 22. Sơ đồ nào sau đây biểu diễn quá trinh oxi hóa.
A. N2 + 6e → 2N3-
B. Fe2+ → Fe3+ + 1e
C. Na+ + Cl- → NaCl
D. NaOH + HCl → NaCl + H2O
Câu 23. Cho 5,4 gam Al tác dụng H2SO4 đặc thu được 6,72 lít khí X (đktc). Tổng hệ số cân bằng là:
A. 12
B. 18
C. 19
D. 20
Câu 24. Cho phản ứng: P + HNO3 + H2O → H3PO4 + NO. Chất bị oxi hóa là:
A. P
B. HNO3
C. H2O
D. H3PO4
Câu 25. Cho m gam Al, Cu tỉ lệ mol 1:1 + HNO3 thu được 11,2 lít khí NO. Giá trị m là:
A. 29,3 gam
B. 27.3 gam
C. 27,1 gam
D. 25,6 gam
Câu 26. Trong phân tử CO2 có bao nhiêu liên kết pi.
A. 4
B. 2
C. 1
D. 3
Câu 27. Cho 21.9 gam Al và Cu tác dụng với HNO3 thu được 6,72 lít khí NO. Tỉ lệ mol của Al và Cu là:
A. 1:3
B. 3:1
C. 2:1
D. 1:2
Câu 28. Cho 0.13 mol Al tác dụng với HNO3 thu được V lít khí N2 va NO theo tỉ lệ mol 1:1 Giá trị của V là:
A. 0.448 lít
B. 1.344 lít
C. 0.672 lít
D. 0.884 lít
Câu 29. Sắp xếp số e trong các ion sau theo thứ tự tăng dần.
NH4+, SO32-, CO32-.
A. NH4+ < SO32- < CO32-
B. NH4+ < CO32- < SO32-
C. SO32- < CO32- < NH4+
D. CO32- < NH4+ < SO32-
Câu 30. Cho m gam hỗn hợp Al, Fe, Cu tác dụng với O2 thu được 19,6 gam chất rắn. Hóa tan hết 19,6 gam chất rắn cần 100 ml dung dịch HCl 12M. Tính m?
A. 10 gam
B. 19.6 gam
C. 18.2 gam
D. 24 gam
Câu 31. Cho nguyên tử X có tổng e ở phân lớp s = 7. X thuộc nhóm A. Cho biết X là nguyên tố nào:
A. Na
B. K
C. O
D. S
Câu 32. Cho các chất sau đây: CO2, CH4, N2, HCl, H2O, O2. Số chất không có sự phân cực.
A. 3
B. 2
C. 4
D. 5
Câu 33. Cho X2+ có cấu hình e: [ Ar] 3d6. Tìm vị trí của X:
....................................
Câu 34. X có hai đồng vị có số khối 13 và 11. Có % đồng vị bằng nhau. 0,25 mol X có khối lượng:
A. 3
B. 12
C/ 4
D. 6
Câu 35. Cho phản ứng: Na + Cl2 → 2NaCl, ∆ H = -882,2 kj
Đây là phản ứng:
A. Thu nhiệt
B. Tỏa nhiệt.
C. Không thu nhiệt.
D. Trao đổi.
Câu 36. X, Y nằm cùng một chu kì, 2 nhóm liên tiếp có tổng e bằng 25. Tính số mol của e nhương đi từ 0,1 mol X và 0.2 mol Y.
A. 0.6
B.0,8
C. 0.7
D. 0.5
Câu 37. Nguyên tố X có công thức oxit cao nhất là: RO2. Trong đó trong hợp chất khí với H %R bằng 75%. Xác định số cặp e liên kết và chưa liên kết trong oxit cai nhất.
A. 4,2
B. 2,0
C. 4,0
D. 2,4
Câu 38. Cho 32 gam hỗn hợp Al, Fe, Zn tác dụng vừa đủ với V lít dung dịch HCl 0,5M thu được 44,2 gam muối. Giá trị V:
A. 0.2 lít
B. 0.4 lít
C. 0.8 lít
D. số khác.
Câu 39. X và Y là hai kim loại kiềm có khối luộng 10,1 gam tác dụng hết nước thoát ra 3,36 lít khí (đktc). Xác định lệ mol X và Y. (MX < MY)
A. 2:3
B. 1:2
C. 2:1
D. 1:1
Câu 40. Nguyên tố X nằm chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây:
A. s
B. p
C. f
D. d
Đáp án:
Nội dung đáp án sẽ sớm được cập nhật, các bạn nhớ F5 liên tục để xem đáp án....
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Bộ đề thi học kì 1 Hóa 10 năm 2021 (Có đáp án) Phần 1 file Word, pdf hoàn toàn miễn phí!
- Đề thi toán lớp 10 học kì 1 THPT Nguyễn Thượng Hiền 2020-2021
- Đề thi Văn lớp 10 học kì 1 trường THPT Bình Thủy năm 2020
- Đáp án Đề thi HK 1 Lớp 10 môn Toán - THPT Lương Thế Vinh Hà Nội 2019
- Đề thi Văn lớp 10 học kì 1 trường THPT Định Quán năm 2020
- Đề thi học kì 1 Văn 10 tỉnh Quảng Nam năm 2020
- Đề thi Toán 10 học kì 1 THPT Chuyên Ngoại Ngữ - ĐHQG Hà Nội 2020
- Đáp án Đề thi học kì 1 Lớp 10 môn Toán THPT Lômônôxốp Hà Nội 2018
- Bộ đề thi học kì 1 môn Sinh lớp 10 năm 2021 (Có đáp án) Phần 1