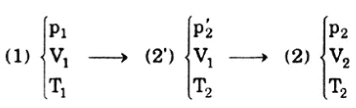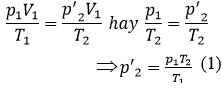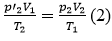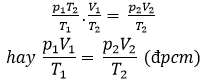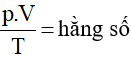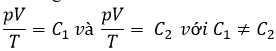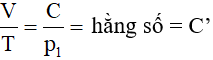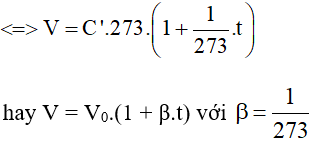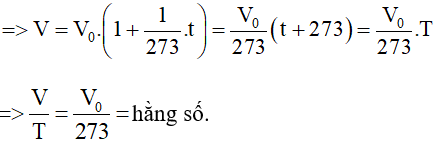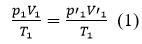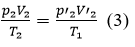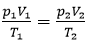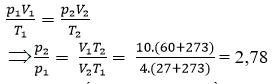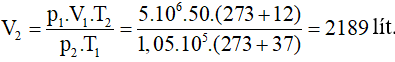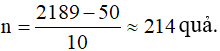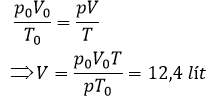Soạn Lí 10 nâng cao Bài 47: Phương trình trạng thái của khí lí tưởng. Định luật Gay Luy - xác
Mời các em học sinh tham khảo ngay nội dung hướng dẫn soạn SGK Vật lý 10 nâng cao Bài 47: Phương trình trạng thái của khí lí tưởng. Định luật Gay Luy - xác được bày chi tiết, dễ hiểu nhất dưới đây sẽ giúp bạn đọc hiểu rõ hơn về bài học này, từ đó chuẩn bị tốt cho tiết học sắp tới nhé.
Trả lời câu hỏi C giữa bài Vật lý lớp 10 nâng cao Bài 47
Câu c1 (trang 232 sgk Vật Lý 10 nâng cao)
Với một lượng khí đã cho thì hằng số trong công thức pV/T = hằng số có một giá trị duy nhất hay có thể có nhiều giá trị?
Lời giải:
HDTL: phương trình trạng thái pV/T= hằng số có dạng chung cho mọi lượng khí khác nhau, nhưng với một lượng khí đã cho thì hằng số ở vế phải có một giá trị C xác định.
Trả lời câu hỏi Vật lí lớp 10 nâng cao Bài 47 trang 233
Câu 1 (trang 233 sgk Vật Lý 10 nâng cao):
Thiết lập phương trình trạng thái cân bằng cách thực hiện giai đoạn biến đổi:
Lời giải:
HDTL: từ trạng thái (1) sang trạng thái (2’) là quá trình biến đổi đẳng tích
Từ trạng thái (2’) sang trạng thái (2) là quá trình biến đổi đẳng nhiệt:
Thế (1) vào (2) ta được:
Câu 2 (trang 233 sgk Vật Lý 10 nâng cao)
Từ phương trình trạng thái (47.4): 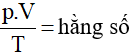
Lời giải:
Từ phương trình:
+ Quá trình biến đổi đẳng nhiệt ta được: T = hằng số → p.V = hằng số (định luật Bôi-lơ – Ma-ri-ôt).
+ Quá trình biến đổi đẳng tích: V = hằng số → p/T = hằng số (định luật Sác-lơ).
Câu 3 (trang 233 sgk Vật Lý 10 nâng cao)
Hai phương trình trạng thái của hai lượng khí khác nhau thì có khác nhau không? Nếu có thì khác nhau ở chỗ nào?
Lời giải:
HDTL: hai pương trình trạng thái của hai lượng khí khác nhau thì có dạng giống nhau nhưng khác nhau về hằng số:
Câu 4 (trang 233 sgk Vật Lý 10 nâng cao)
Viết phương trình biểu diễn định luật Bôi-lơ – Ma-ri-ôt đối với cùng một lượng khí nhưng ở hai nhiệt độ tuyệt đối khác nhau. Hai phương trình ấy có khác nhau không? Nếu có thì khác ở chỗ nào?
Lời giải:
Từ phương tình trạng thái khí lí tưởng: p.V/T = hằng số = C.
Quá trình đẳng nhiệt: T = hằng số ⇒ p.V = C.T1 ứng với nhiệt độ T1.
Và p.V = CT2 ứng với nhiệt độ T2.
Hai phương trình p.V = C.T1 và p.V = C.T2 khác nhau hằng số ở vế phải.
Câu 5 (trang 233 sgk Vật Lý 10 nâng cao)
Từ phương trình (47.5): 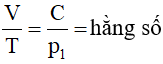
Lời giải:
Ta có:
⇒ V = C’.T = C’.(t + 273).
Ngược lại:
Nếu ta có: V = V0.(1 + β.t)
Câu 6 (trang 233 sgk Vật Lý 10 nâng cao)
Từ định luật Boilo- Mariot và định luật Gay Luy-xac suy ra phương trình trạng thái của chất khí.
Lời giải:
HDTL: xét một lượng khí không đổi, biến đổi trạng thái qua hai quá trình:
- Quá trình đẳng nhiệt:
Quá trình đẳng áp từ (2’) → (2)
- Từ (1) và (3) suy ra
Giải bài tập SGK Vật lí 10 nâng cao Bài 47 trang 233
Bài 1 (trang 233 sgk Vật Lý 10 nâng cao)
Đối với một lượng khí xác định, quá trình nào sau đây là đẳng áp?
A. Nhiệt độ không đổi, thể tích tăng.
B. Nhiệt độ không đổi, thể tích giảm.
C. Nhiệt độ tăng, thể tích tăng tỉ lệ thuận với nhiệt độ.
D. Nhiệt độ giảm, thể tích tăng tỉ lệ nghịch với nhiệt độ.
Lời giải:
Đáp án: C.
Quá trình đẳng áp: p = hằng số suy ra V/T = hằng số ⇒ V tăng tỉ lệ thuận với nhiệt độ khi nhiệt độ tăng.
Bài 2 (trang 233 sgk Vật Lý 10 nâng cao)
Nén 10l khí ở nhiệt độ 27℃ để cho thể tích của nó chỉ còn 4l, vì nén nhanh khí bị nóng lên đến 60℃. Hỏi áp suất của khí tăng lên bao nhiêu lần? (có thể đối chiếu với bài tập 3 ở bài định luật Boilo-Mariot)
Lời giải:
Áp dụng phương trình trạng thái lí tưởng:
Vậy áp suất tăng lên 2,78 lần
Bài 3 (trang 233 sgk Vật Lý 10 nâng cao)
Một bình bằng thép dung tích 50l chứa khí hiđro ở áp suất 5 Mpa và nhiệt độ 37oC. Dùng bình này bơm được bao nhiêu quả bóng bay, dung tích mỗi quả 10 l, áp suất mỗi quả 1,05.105 Pa? Nhiệt độ trong bóng bay là 12oC.
Lời giải:
Ở nhiệt độ 12oC và áp suất 1,05.105 Pa, thể tích lượng khí hiđro là:
Số bóng bay bơm được:
Bài 4 (trang 233 sgk Vật Lý 10 nâng cao)
Một mol khí ở áp suất 2atm và nhiệt độ 30℃ thì chiếm một thể tích là bao nhiêu?
Lời giải:
ở đktc: 1 mol khí có thể tích, nhiệt độ, áp suất là:
Vo= 22,4 lít; To = 273K; po = 1,013.105Pa
Áp dụng phương trình trạng thái lí tưởng:
►► CLICK NGAY vào đường dẫn dưới đây để TẢI VỀ lời giải Lí 10 nâng cao Bài 47: Phương trình trạng thái của khí lí tưởng. Định luật Gay Luy - xác chi tiết, đầy đủ nhất, file pdf hoàn toàn miễn phí từ chúng tôi, hỗ trợ các em ôn luyện giải đề đạt hiệu quả nhất.
- Soạn Lí 10 nâng cao Bài 48: Phương trình Cla-pê-rôn - Men-đê-lê-ép
- Soạn Lí 10 nâng cao Bài 47: Phương trình trạng thái của khí lí tưởng. Định luật Gay Luy - xác
- Soạn Lí 10 nâng cao Bài 46: Định luật Sác lơ. Nhiệt độ tuyệt đối
- Soạn Lí 10 nâng cao Bài 45: Định luật Bôi-lơ - Ma-ri-ốt
- Soạn Lí 10 nâng cao Bài 44: Thuyết động học phân tử chất khí. Cấu tạo chất