So sánh Ankadien và Anken đầy đủ và ngắn gọn nhất
Dưới đây là bảng so sánh Anken và Ankadien chi tiết được đội ngũ chuyên gia biên soạn và chia sẻ đến các em, hy vọng sẽ giúp các em có cái nhìn rõ ràng hơn về sự khác biệt giữa hai loại hợp chất hữu cơ này.
Bảng so sánh Anken và Ankadien chi tiết
| Anken | Ankadien | |
| CTPT chung | CnH2n (n>=2) | CnH2n-2(n>=3) |
| Đặc điểm cấu tạo chung | - Có một liên kết đôi C=C trong phân tử - Đồng phân mạch Cacbon và đồng phân vị trí liên kết đôi, một số có đồng phân hình học. | - Có 2 liên kết đôi C=C trong phân tử. - Đồng phân mạch Cacbon và đồng phân vị trí liên kết đôi, một số có liên kết hóa học. |
| Tính chất vật lý | C3 - C4 là chất khí C5 là chất lỏng hoặc rắn Nhẹ hơn nước, không tan trong nước. | Từ C3 - C4 là chất khí, C5 - C16 trở đi là chất lỏng, từ C17 trở đi là chất rắn. Không tan trong nước nhưng tan trong một số dung môi hữu cơ. |
| Tính chất hóa học | - Phản ứng cộng - Phản ứng trùng hợp - Phản ứng oxi hóa | - Phản ứng cộng - Phản ứng trùng hợp - Phản ứng oxi hóa |
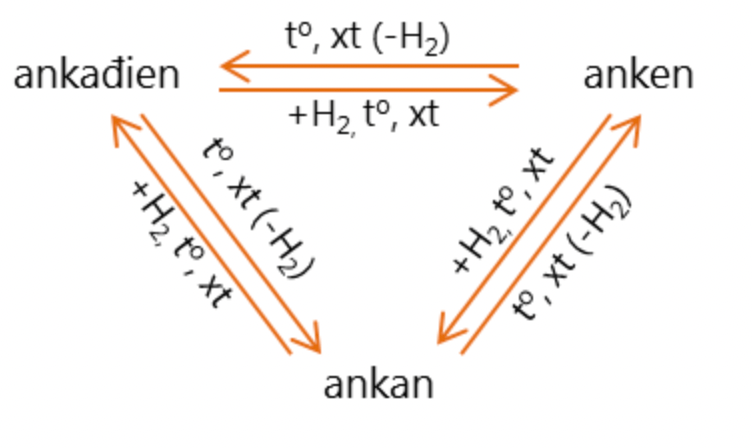
Sự chuyển hóa lẫn nhau giữa Anken và Ankadien
Kiến thức tham khảo về Anken và Ankadien
Anken:
Các anken C2H4, C3H6, C4H8,… có công thức chung là CnH2n (n lớn hơn hoặc bằng 2), chúng lập thành dãy đồng đẳng của etilen
- Tính chất vật lý
Ở điều kiện thường, các anken từ C2 đến C4 ở thể khí, từ C5 trở đi là chất lỏng hoặc chất rắn. Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng theo chiều tăng của phân tử khối. Nhẹ hơn nước, ít tan trong nước, chúng tan nhiều trong các dung môi hữu cơ. Các anken đều không màu.
- Tính chất hóa học anken
+ Phản ứng cộng
Cộng H2: CH2 = CH2 + H2 -> CH3 – CH3
Cộng halogen (Cl2, Br2): CH2 = CH2 + Br2 -> CH2Br – CH2Br
Ta kết luận: các đồng đẳng của etilen làm mất màu dung dịch brom. Tính chất hóa học này dùng để nhận biết etilen và các đồng đẳng thuộc dãy anken trong hỗn hợp khí
Cộng HX
Quy tắc Maccopnhicop: Khi cộng HX vào liên kết đôi thì X ưu tiên cộng vào nguyên tử C bậc cao hơn (ít H hơn)
CH2 = CH – CH2 + H – OH -> CH2OH – CH2 – CH3 (sản phẩm chính)
CH2 = CH – CH2 + H – OH -> CH3 – CHOH – CH3 (sản phẩm phụ)
+ Phản ứng trùng hợp
n CH2 = CH2 -> ( CH2 – CH2 ) n (polietilen – PE)
+ Phản ứng oxi hóa
Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
CnH2n + 3n/ 2 O2 -> n CO2 + n H2O -> n CO2 = n H2O
Phản ứng oxi hóa không hoàn toàn trong lý thuyết anken.
3 CnH2n + 2 KMnO4 + 4 H2O -> 2 CnH2n (OH)2 + 2 KOH + 2 MnO2
3 CH2 = CH2 + 2 KMnO4 + 4 H2o -> 2 CH2(OH) – CH2(OH) + 2 MnO2 + KOH
Phản ứng này làm mất màu dung dịch KMnO4 và có kết tủa nâu đen MnO2 xuất hiện.
Ankadien:
Ankadien là hidrocacbon mạch hở, có hai liên kết đôi C = C trong phân tử, có công thức chung là Cn H2n-2 (n phải lớn hơn hoặc bằng 3)
- Phân loại
Ankadien có hai liên kết đôi cạnh nhau: CH2 = C = CH2
Ankadien có hai liên kết đôi cách nhau một liên kết đơn (ankadien liên hợp)
CH2 = CH – CH = CH2 (buta – 1,3 dien / butadien / đi vinyl)
CH2 = C(CH3) – CH = CH2 ( 2 – metylbuta – 1,3 dien/ isopren)
Ankadien có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên
CH2 = CH – CH2 – CH = CH2 (penta - 1,4 – dien)
- Tính chất hóa học
+ Phản ứng cộng
Cộng H2: CH2 = CH – CH = CH2 + 2 H2 -> CH3 – CH2 – CH2 – CH3
Cộng halogen (Br2, Cl2)
Cộng 1, 2: CH2 = CH – CH = CH2 + Br2 -> CH2 = CH – CHBr – CH2Br (sản phẩm chính)
CH2Br - CH = CH – CH2Br (sản phẩm phụ)
+ Phản ứng trùng hợp
n CH2 = CH – CH = CH2 -> ( CH2 – CH = CH – CH2 ) (polibutadien/ cao su buna)
n CH2 = C(CH3) – CH = CH2 -> (CH2 – C (CH3) = CH – CH2) n (cao su isopren)
+ Phản ứng oxi hóa
Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
Cn H 2n-2 + (3n-1)/2 O2 -> n CO2 + (n-1) H2O
Vậy ta có n (CO2) > n (H2O)
Và n (ankadien) = n (CO2) – n (H2O).
Phản ứng oxi hóa không hoàn toàn: tương tự anken, ankadien có khả năng làm mất màu dung dịch KMnO4.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về So sánh Anken và Ankadien đầy đủ và ngắn gọn nhất file PDF hoàn toàn miễn phí.
- Giải bài tập Hóa 11: Công thức phân tử hợp chất hữu cơ trang 95 đầy đủ
- So sánh Ankadien và Anken đầy đủ và ngắn gọn nhất
- Giải Bài 42 Hóa 11: Luyện tập : Dẫn xuất halogen, ancol, phenol
- Hướng dẫn soạn Hóa 11 Bài 25: Ankan đầy đủ nhất
- [ĐÁP ÁN] Tính chất hóa học cơ bản của NH3 là gì?
- [LỜI GIẢI] Chất nào sau đây là chất điện li mạnh?
- Giải Hóa 11 Bài 27: Luyện tập : Ankan và xicloankan (ngắn gọn)
- Giải bài 24 Hóa học 11: Luyện tập trang 107, 108 chi tiết nhất