Soạn Hóa 8 Bài 24: Tính chất của oxi đầy đủ nhất
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài tập ứng dụng, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn Hóa 8 Bài 24: Tính chất của oxi đầy đủ nhất, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Hóa 8 Bài 24: Tính chất của oxi
Bài tập ứng dụng
Bài 1(trang 84 SGK Hóa 8):
Dùng từ thích hợp trong khung để điền vào chỗ trống trong các câu sau:
Kim loại, phi kim, rất hoạt động, phi kim rất hoạt động, hợp chất.
Khí oxi là một đơn chất ..……….. Oxi có thể phản ứng với nhiều ……………., ……………, ……………..
Hướng dẫn giải chi tiết:
Khí oxi là một đơn chất phi kim rất hoạt động. Oxi có thể phản ứng với nhiều phi kim, kim loại, hợp chất.
Bài 2(trang 84 SGK Hóa 8):
Nêu các thí dụ chứng minh rằng oxi là một đơn chất rất hoạt động (đặc biệt ở nhiệt độ cao)
Hướng dẫn giải chi tiết:
Oxi là một đơn chất rất hoạt động (đặc biệt ở nhiệt độ cao), ví dụ:
3Fe + 2O2 → Fe3O4.
S + O2 → SO2.
Bài 3(trang 84 SGK Hóa 8):
Butan có công thức C4H10 khi cháy tạo ra khí cacbonic và hơi nước, đồng thời tỏa nhiều nhiệt. Viết phương trình hóa học biểu diễn sự cháy của butan.
Hướng dẫn giải chi tiết:
Phương trình hóa học:
2C4H10 + 13O2 ->(nhiệt độ) 8CO2 + 10H2O
Bài 4(trang 84 SGK Hóa 8):
Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, trắng).
a) Photpho hay oxi chất nào còn thừa và số mol chất còn thừa là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
Hướng dẫn giải chi tiết:
a)
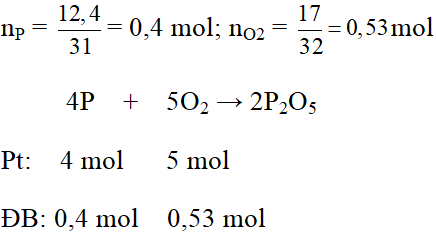
Xét tỉ lệ số mol đề bài với số mol phương trình của P và O2 ta có:
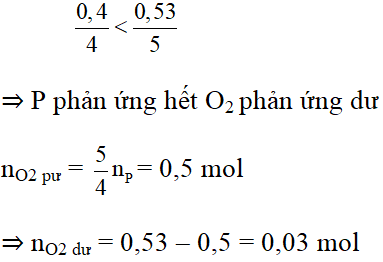
b) Chất tạo thành: đi photpho pentaoxit P2O5
Theo phương trình 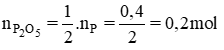
mP2O5 = n.M = 0,2.(31.2 + 16.5) = 28,4 (g)
Bài 5(trang 84 SGK Hóa 8):
Đốt cháy hoàn toàn 24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn).
Hướng dẫn giải chi tiết:
Đổi: 24kg = 24000g
24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được

⇒ nS = 120 / 32 = 3,75 mol
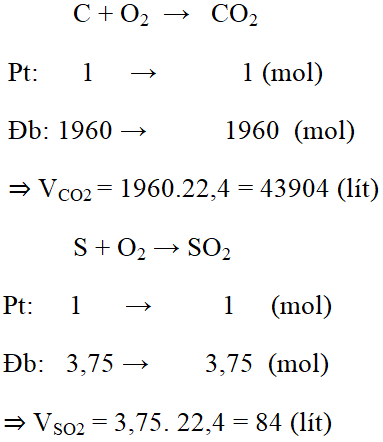
Bài 6(trang 84 SGK Hóa 8):
Giải thích tại sao:
a) Khi nhốt một con dế mèn (hoặc con châu chấu) vào một lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết.
b) Người ta phải bơm sục không khí vào các bể nuôi cá cảnh hoặc các chậu, bể chứa cá sống ở các cửa hàng bán cá.
Hướng dẫn giải chi tiết:
a) Con dế mèn sẽ chết vì thiếu khí oxi. Khí oxi duy trì sự sống.
b) Phải bơm sục không khí vào các bể nuôi cá để cung cấp oxi cho cá (vì oxi tan một phần trong nước.
Bộ câu hỏi trắc nghiệm:
Câu 1: Khí oxi nặng hơn không khí bao nhiêu lần
A. 1,1 lần
B. 0,55 lần
C. 0,90625 lần
D. 1,8125 lần
Câu 2: Đốt cháy 3,1 g photpho trong bình chứa oxi tạo ra điphotpho pentaoxit. Tính khối lượng oxit thu được
A. 1,3945 g
B. 14,2 g
C. 1,42 g
D. 7,1 g
Câu 3: Cháy mạnh, sáng chói, không có khói là hiện tượng của phản ứng
A. C+O2 → CO2
B. 3Fe+2O2 → Fe3O4
C. 2Cu+O2 → 2CuO
D. 2Zn+O2 → 2ZnO
Câu 4: Cháy trong oxi với lửa nhỏ có màu xanh nhạt, cháy trong không khí mãnh liệt hơn là hiện tượng của phản ứng
A. 2S + 3O2 → 2SO3
B. S + O2 → SO2
C. P + O2 → P2O5
D. P + O2 →P2O5
Câu 5: Cháy mạnh trong oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ dưới dạng bột hòa tan được nước là phản ứng
A. 4P + 5O2 → 2P2O5
B. P + O2 → P2O3
C. S + O2 →SO2
D. 2Zn + O2 →2 ZnO
Câu 6: Cho 0,56 g Fe tác dụng với 16 g oxi tạo ra oxit sắt từ. Tính khối lượng oxit sắt từ và cho biết chất còn dư sau phản ứng
A. Oxi dư và m = 0,67 g
B. Fe dư và m = 0,774 g
C. Oxi dư và m = 0,773 g
D. Fe dư và m = 0,67 g
Câu 7: Tính chất nào sau đây oxi không có
A. Oxi là chất khí
B. Trong các hợp chất, oxi có hóa trị 2
C. Tan nhiều trong nước
D. Nặng hơn không khí
Câu 8: Chọn đáp án đúng
A. Oxi không có khả năng kết hợp với chất hemoglobin trong máu
B. Khí oxi là một đơn chất kim loại rất hoạt động
C. Oxi nặng hơn không khí
D. Oxi có 3 hóa trị
Câu 9: Chọn đáp án đúng
A. CH4 + O2 → 2CO2 + H2O
B. 2C2H2 +5O2→ 4CO2 + 2H2O
C. Ba + O2 → BaO
D. 2KClO3 → 2KCl + O2
Câu 10: Tính thể tích khí oxi phản ứng khi đốt cháy 3,6 g C
A. 0,672 l
B. 67,2 l
C. 6,72 l
D. 0,0672 l
Đáp án:
1.A 2.D 3.B 4.A 5.A
6.C 7.C 8.C 9.B 10.C
Câu 1:Hướng dẫn:
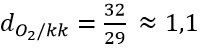
Câu 2:
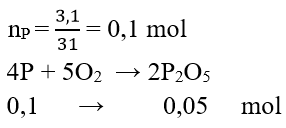
mP2O5= 0,05.142 = 7,1 g
Câu 6:
nFe = 0,56/56 = 0,01 mol, nO2 = 16/32 = 0,5 mol
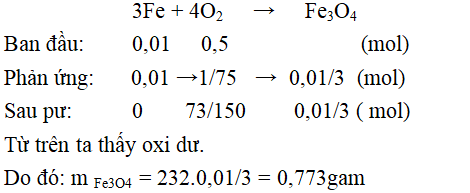
Câu 10: C + O2 → CO2
nC = 3,6/12 = 0,3 mol
nhìn vào phương trình thấy số mol của C bằng số mol oxi phản ứng
⇒ VO2 = 0,3.22,4 = 6,72 l
Lý thuyết trọng tâm:
- Kí hiệu hóa học : O
- CTHH : O2
- Nguyên tử khối: 16. Phân tử khối: 32
1. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
2. Tính chất hóa học
a. Tác dụng với phi kim
- Với lưu huỳnh
- Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi manh liệt hơn, tạo thành khí lưu huỳnh dioxit SO2 (còn gọi là khí sunfuro) và rất ít lưu huỳnh trioxit SO3
- PTHH:
S + O2 −to→ SO2
Với photpho:
Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong không khí. Bột trắng đó là điphotpho pentaoxit có CTHH là P2O5.
PTHH:
4P + 5O2 −to→ 2P2O5
⇒ Vậy oxi có thể tác dụng với phi kim khi ở nhiệt độ cao. Trong hợp chất oxi hóa trị II
b. Tác dụng với kim loại
Cho dây sắt cuốn một mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hóa học là Fe3O4, thường được gọi là oxit sắt từ
PTHH:
3Fe + 2O2 −to→ Fe3O4
c. Tác dụng với hợp chất:
Khí metan (có trong khí bùn, ao, bioga) cháy trong không khí do tác dụng với oxi, tỏa nhiều nhiệt
CH4 + 2O2 −to→ CO2 + H2O
⇒ Oxi có thể tác dụng với kim loại, phi kim và các hợp chất ở nhiệt độ cao. Trong các hợp chất hóa học oxi hóa trị II.
File tải hướng dẫn soạn Hóa 8 Bài 24:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô giáo tham khảo, chuẩn bị tốt cho bài học mới!
►Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi môn Hóa học như đề kiểm tra học kì, 1 tiết, 15 phút trên lớp, hướng dẫn giải sách giáo khoa, sách bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.
- Soạn Hóa 8 Bài 24: Tính chất của oxi đầy đủ nhất
- Giải Hóa học 8 Bài 28: Không khí - Sự cháy (Ngắn gọn nhất)
- Giải bài tập Hóa học 8 Bài 29: Bài Luyện tập 5 | Hay nhất
- Giải bài tập Hóa học 8 Bài 26: Oxit | Hay nhất
- Giải bài tập SGK Hóa học 8 Bài 25 trang 87 (đầy đủ nhất)
- Giải bài tập Hóa học 8 Bài 27: Điều chế khí oxi - Phản ứng phân hủy
- Giải Hoá học 8 Bài 30: Bài thực hành 4 trang 103 SGK