Giải Hóa 8 Bài 11: Bài luyện tập 2 SGK trang 41
Hóa 8 Bài 11: Bài luyện tập 2 giúp các em tổng hợp lại nội dung kiến thức đã học trong chương 1 từ đó ứng dụng giải các bài tập dạng tổng quát, nâng cao.
Giải bài tập SGK Hóa 8 bài 11: Luyện tập 2
Bài 1: (trang 41 SGK Hóa 8)
Hãy tính hóa trị của đồng Cu, photpho P, silic Si, và sắt Fe trong các công thức hóa học sau: Cu(OH)2, PCl5, SiO2, Fe(NO3)3.
Biết các nhóm (OH), (NO3), Cl đều hóa trị I.
Lời giải:
Gọi hóa trị của các chất cần tính là a. Ta có:
- Cu(OH)2 1.a = I x 2 ⇒ a = II
Hay Cu có hóa trị II.
- PCl5 1.a = I x 5 ⇒ a = V
Hay P có hóa trị V.
- SiO2 1.a = II x 2 ⇒ a = IV
Hay Si có hóa trị IV.
- Fe(NO3)3 1.a = I x 3 ⇒ a = III
Hay Fe có hóa trị III.
Bài 2: (trang 41 SGK Hóa 8)
Cho biết công thức hóa học của hợp chất của nguyên tố X với O và hợp chất của nguyên tố Y với H như sau (X, Y là những nguyên tố nào đó): XO, YH3.
Hãy chọn công thức hóa học nào là đúng cho hợp chất của X với Y trong số các công thức sau đây:
A. XY3.
B. X3Y.
C. X2Y3.
D. X3Y2.
E. XY.
Lời giải:
* Gọi hóa trị của X trong công thức 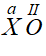 là a
là a
Theo quy tắc hóa trị ta có : a.1 = II.1 ⇒ a = II
⇒ X có hóa trị II
* Gọi hóa trị của Y trong công thức 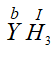 là b
là b
Theo quy tắc hóa trị ta có : b.1 = I.3 ⇒ b = 3
⇒ Y có hóa trị III
* Hợp chất X(II) và Y(III) có công thức dạng chung là 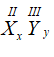
Theo quy tắc hóa trị ta có : II.x = III.y ⇒ 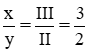 ⇒ x = 3, y = 2
⇒ x = 3, y = 2
⇒ Công thức là X3Y2.
Chọn đáp án D
Bài 3: (trang 41 SGK Hóa 8)
Theo hóa trị của sắt trong hợp chất có công thức hóa học là Fe2O3 hãy chọn công thức hóa học đúng trong số các công thức hợp chất có phân tử Fe liên kết với (SO4) hóa trị (II) sau:
A. FeSO4.
B. Fe2SO4.
C. Fe2(SO4)2.
D. Fe2(SO4)3.
E. Fe3(SO4)2.
Lời giải:
* Gọi hóa trị của Fe trong công thức 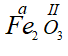 là a.
là a.
Theo quy tắc hóa trị ta có: a.2 = II.3 ⇒ a = III ⇒ Fe có hóa trị III
* Công thức dạng chung của Fe(III) và nhóm SO4 hóa trị (II) là 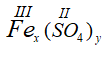
Theo quy tắc hóa trị ta có: III.x = II. y ⇒ 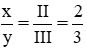 ⇒ chọn x = 2, y = 3
⇒ chọn x = 2, y = 3
⇒ Công thức hóa học là Fe2(SO4)3
Chọn đáp án D
Bài 4: (trang 41 SGK Hóa 8)
Lập công thức hóa học và tính phân tử khối của hợp chất có phần tử gồm kali K(I), bari Ba(II), nhôm Al(III) lần lượt liên kết với:
a) Cl.
b) Nhóm (SO4).
Lời giải:
a) * Gọi công thức hóa học chung của K(I) và Cl (I) là 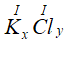
Theo quy tắc hóa trị ta có:
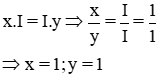
Vậy CTHH của KxCly là KCl
Phân tử khối : 39 + 35,5 = 74,5 đvC
* Gọi công thức hóa học chung của Ba(II) và Cl (I) là 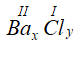
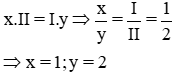
Vậy CTHH của BaxCly là BaCl2
Phân tử khối : 137 + 35,5 x 2 = 208 đvC
* Gọi công thức hóa học chung của Al(III) và Cl (I) là 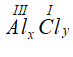
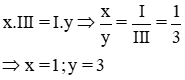
Vậy CTHH của AlxCly là AlCl3
Phân tử khối : 27 + 35,5 x 3 = 133,5 đvC
b) * Gọi công thức hóa học chung của K(I) và SO4 (II) là 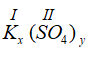
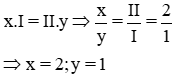
Vậy CTHH của Kx(SO4)y là K2SO4
Phân tử khối : 39.2 + 32 + 16 x 4 = 174 đvC
* Gọi công thức hóa học chung của Ba(II) và SO4 (II) là 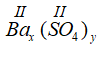
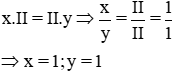
Vậy CTHH của Bax(SO4)y là BaSO4
Phân tử khối : 137 + 32 + 16 x 4 = 233 đvC
* Gọi công thức hóa học chung của Al(III) và SO4 (II) là 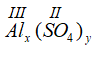
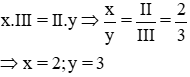
Vậy CTHH của Alx(SO4)y là Al2(SO4)3
Phân tử khối : 27.2 + (32 + 16 x 4).3 = 342 đvC
Lý thuyết trọng tâm chương 1 Hóa học 8
1.Chất có ở đâu?
a.Vật thể:
- Vật thể tự nhiên gồm có một số chất khác nhau.
VD: khí quyển gồm có các chất khí như nito, oxi,… ; trong thân cây mía gồm các chất: đường (tên hóa học là saccarozo), nước, xenlulozo,…; đá vôi có thành phần chính là chất canxi cacbonat.
- Vật thể nhân tạo được làm bằng vật liệu. Mọi vật liệu đều là các chất hay hỗn hợp mộit số chất.
VD: ấm đun bằng nhôm, bàn bằng gỗ, lọ hoa bằng thủy tinh,…
b. Chất có ở đâu?
Chất có trong tự nhiên ( đường, xenlolozo,…)
Chất do con người điều chế được, như: chất dẻo, cao su,…
2. Tính chất của chất
- Tính chất vật lí: trạng thái (rắn, lỏng, khí), màu, mùi vị, tính tan, nhiệt độ nóng chảy, nhiệt độ sôi,…
- Tính chất hóa học: là khả năng biến đổi thành chất khác. VD: khả năng phân hủy, tình cháy,…
- Các cách nhận biết:
+ Quan sát: giúp nhận ra tính chất bên ngoài
+ Dùng dụng cụ đo: xác định nhiệt độ nông chảy, nhiệt độ sôi, khối lượng riêng,..
+ Làm thí nghiệm: xác định tính tan, dẫn điện, dẫn nhiệt,…
- Lợi ích của việc hiểu biết tính chất của chất:
+ Nhận biết chất, phân biệt chất này với chất khác
+ Biết cách sử dụng chất
+ Biết ứng dụng chất thích hợp trong đời sống và sản xuất
3. Chất tinh khiết
- Hỗn hợp: là hai hay nhiều chất trộn lẫn với nhau
VD: nước biển, nước khoang, nước muối,…
- Chất tinh khiết: là chất không có lẫn chất khác
VD: nước cất
- Cách tách chất ra khỏi hỗn hợp: dựa vào sự khác nhau của tính chất vật lý.
4. Khái niệm nguyên tử
- Nguyên tử là những hạt vô cùng nhỏ và trung hòa về điện.
VD: Kim loại natri được cấu tạo từ rất nhiều nguyên tử natri
- Đường nguyên tử vào khoảng 10-8 cm
- Nguyên tử gồm:
+ Hạt nhân mang điện tích dương
+ Vỏ tạo bởi một hay nhiều electron mang điện tích âm.
- Electron, kí hiệu là e, có điện tích âm nhỏ nhất và quy ước ghi bằng dấu (-)
5. Hạt nhân nguyên tử
- Được cấu tạo bởi proton và notron.
+ Proton được kí hiệu là p, có điện tích như electtron nhưng khác dấu, ghi bằng dâu (+)
+ Notron không mang điện, kí hiệu là n
- Trong một nguyên tử:
Số p = số e
- Proton và nơtron có cùng khối lượng, khối lượng của e rất bé
- Khối lượng của hạt nhân được coi là khối lượng của nguyên tử
6. Lớp electron
- Electron luôn chuyển động rất nhanh quanh hạt nhân và được sắp xếp thành từng lứp, mỗi lớp có một số e nhất định
- Nguyên tử có thể liên kết với nhau nhờ electron
7. Nguyên tố hóa học là gì?
a. Định nghĩa
Nguyên tố hóa học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân
Số proton là đặc trưng của một nguyên tố hóa học
Các nguyên tử thuộc cùng một nguyên tố có tính chất giống nhau
b. Kí hiệu hóa học:
Dùng để biểu diễn nguyên tố hóa học
Kí hiệu hóa học được biểu diễn bằng một hoặc hai chữ cái, chữ đầu được viết in hoa.
VD: kí hiệu nguyên tố canxi là Ca, nguyên tố Xesi là Cs, nguyên tố kali là K,…
+ Quy ước: mỗi kí hiệu của nguyên tố chỉ một nguyên tử nguyên tố đó.
8. Nguyên tử khối
Nguyên tử có khối lượng vô cùng bé, nếu tính bằng gam thì số trị quá nhỏ
Khối lượng nguyên tử C bằng 1,9926.10-23 g
- Quy ước: lấy 1/12 khối lượng nguyên tử C làm đơn vị khối lượng nguyên tử gọi là đơn vị cacbon (đvC), kí hiệu là u
Dựa theo đơn vị này để tính khối lượng nguyên tử
Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon
Có thể so sánh độ nặng nhẹ giữa các nguyên tố bằng việc lập tỉ số giữa các nguyên tử khối:
+ Nếu lớn hơn 1: nặng hơn
+ Nếu nhỏ hơn 1: nhẹ hơn
+ Nếu bằng 1: bằng nhau
VD: giữa nguyên tử oxi và photpho, nguyên tử nào nhẹ hơn:
Lập tỉ số 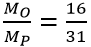 < 1 ⇒ nguyên tử oxi nhẹ hơn photpho
< 1 ⇒ nguyên tử oxi nhẹ hơn photpho
Mỗi nguyên tố đều có nguyên tử khối riêng biệt ⇒ có thể xác định nguyên tố thông qua nguyên tử khối
9. Có bao nhiêu nguyên tố hóa học?
Đến nay, có hơn 110 nguyên tố hóa học.
Oxi là nguyên tố phổ biến nhất, chiếm gần nửa khối lượng vỏ Trái Đất.
Trên đây là toàn bộ hướng dẫn giải bài tập SGK trang 41 của Hóa 8 Bài 11: Luyện tập 2 kèm tổng hợp lý thuyết trọng tâm trong chương 1. Hy vọng sẽ là tài liệu tham khảo hữu ích dành cho các em học sinh và quý thầy cô.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hóa 8 Bài 11: Bài luyện tập 2 SGK trang 41 file Word, pdf hoàn toàn miễn phí!
- Giải Hoá học 8 Bài 5: Nguyên tố hóa học trang 20 SGK
- Giải Hóa 8 Bài 11: Bài luyện tập 2 SGK trang 41
- Giải bài tập SGK Hóa 8 Bài 4: Nguyên tử hay và ngắn gọn nhất
- Giải Hoá học 8 Bài 8: Bài luyện tập 1 trang 30, 31 SGK
- Giải Hoá học 8 Bài 7: Bài thực hành 2 trang 28 SGK
- Giải Hoá học 8 Bài 9: Công thức hóa học trang 33, 34 SGK
- Giải Hoá học 8 Bài 2: Chất trang 11 SGK tổng hợp
- Giải Hoá học 8 Bài 3: Bài thực hành 1 trang 13 SGK