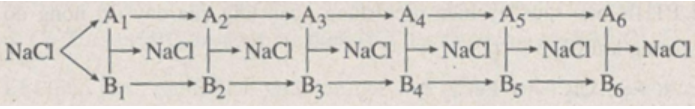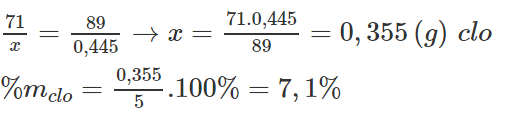Giải SBT Hóa học 10 Bài 21: Khái quát về nhóm halogen (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 10 Bài 21: Khái quát về nhóm halogen (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 10 Bài 21 SBT: Khái quát về nhóm halogen
Bài 21.1 trang 50 sách bài tập Hóa 10
Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5
A. Nhóm IVA.
B. Nhóm VA.
C. Nhóm VIA.
D. Nhóm VIIA.
Lời giải:
Đáp án D
Bài 21.2 trang 50 sách bài tập Hóa 10
Các nguyên tử halogen đều có
A. 3e ở lớp electron ngoài cùng.
B. 5e ở lớp electron ngoài cùng.
C. 7e ở lớp electron ngoài cùng.
D. 8e ở lớp electron ngoài cùng.
Lời giải:
Đáp án C
Bài 21.3 trang 50 sách bài tập Hóa 10
Đặc điểm nào dưới đây là đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I)
A. Ở điều kiện thường là chất khí
B. Có tính oxi hóa mạnh
C. Vừa có tính oxi hóa, vừa có tính khử
D. Tác dụng mạnh với nước
Lời giải:
Đáp án B
Bài 21.4 trang 50 sách bài tập Hóa 10
Tính chất nào sau đây không phải là tính chất chung của các nguyên tử halogen
A. Nguyên tử có khả năng thu thêm 1 electron
B. Tác dụng với hidro tạo thành hợp chất có liên kết cộng hóa trị có cực
C. Có số oxi hóa -1 trong mọi hợp chất
D. Lớp electron ngoài đều có 7 electron
Lời giải:
Đáp án C
Bài 21.5 trang 50 sách bài tập Hóa 10
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tư của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron
A. nhận thêm 1 electron
B. nhận thêm 2 electron
C. nhường đi 1 electron
D. nhường đi 7 electron
Lời giải:
Đáp án A
Bài 21.6 trang 51 sách bài tập Hóa 10
Xác định các chất trong sơ đồ chuyển hoá sau :
Lời giải:
A1, B1 là Na, Cl2
A2, B2 là Na2O, HCl
A3, B3 là NaOH, CaCl2
A4, B4 là Na2CO3, ZnCl2
A5, B5 là Na3PO4, MgCl2
A6, B6 là Na2SO4, BaCl2
Bài 21.7 trang 51 sách bài tập Hóa 10
Một nguyên tố halogen có cấu hình electron lớp ngoài cùng của nguyên tử là 4s24p5
a) Viết cấu hình electron đầy đủ của nguyên tử nguyên tố đó.
b) Cho biết tên, kí hiệu hoá học và cấu tạo phân tử của đơn chất halogen này.
c) Nêu tính hoá học cơ bản của nguyên tố trên.
d) So sánh tính chất hoá học của nguyên tố này với 2 nguyên tố halogen khác đứng trên và dưới nó trong nhóm halogen.
Lời giải:
a) 1s22s22p63s23p64s24p5
b) Đó là brom, kí hiệu hoá học là Br, phân tử gồm 2 nguyên tử liên kết với nhau bằng 1 liên kết cộng hoá trị.
c) Tính chất hoá học cơ bản là tính oxi hoá mạnh.
d) Brom có tính oxi hoầ yếu hơn clo nhưng mạnh hơn iot.
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Bài 21.8 trang 51 sách bài tập Hóa 10
Viết PTHH của các phản ứng xảy ra khi cho clo và iot lần lượt tác dụng với dung dịch KOH ở nhiệt độ thường. Giải thích vì sao có sự khác nhau ở 2 phản ứng đó:
Lời giải:
Cl2 + 2KOH → KCl + KClO + H2O
3I2 + 6KOH → 5KI + KIO3 + 3H2O
Trong môi trường kiềm, ion XO- phân huỷ theo phản ứng sau :
3XO- → 2X- + XO3- (kí hiệu X là halogen)
Ion ClO- phân huỷ rất chậm ở nhiệt độ thường, phân huỷ nhanh ở nhiệt độ trên 75°C
Ion IO- phân huỷ ở tất cả các nhiệt độ trên, do đó ở nhiệt độ thường, ta có 2 phản ứng trên.
Bài 21.9 trang 51 sách bài tập Hóa 10
Cho 5 gam brom có lẫn tạp chất là clo vào một dung dịch chứa 1,600 gam KBr. Sau phản ứng làm bay hơi dung dịch thì thu được 1,155 gam chất rắn khan. Xác định % về khối lượng của clo trong 5 gam brom đem phản ứng.
Lời giải:
Khi cho 5g Br2 có lẫn Cl2 phản ứng với KBr thì khối lượng muối giảm là :
1,600 - 1,155 = 0,445 (g)
Cl2 + 2KBr → 2KCl + Br2
Lý thuyết 71 g 238 g 149 g khối lượng muối giảm đi 238 – 149 = 89 g
Thực tế: x g 0,445 g khối lượng muối giảm
Ta có:
Bài 21.10 trang 51 sách bài tập Hóa 10
Khi cho 20m3 không khí có chứa khí clo đi qua một ống đựng muối KBr, khối lượng của muối đó giảm bớt 178 mg. Xác-định làm lượng của khí clo (mg/m3) trong không khí.
Lời giải:
Cl2 + 2KBr → 2KCl + Br2
1 mol 238 g 149 g 1 mol; khối lượng muối giảm 89 g
x mol
0,178g
x = 0,178/89 = 0,002 mol
Lượng khí clo có trong 20m3 không khí là :
71.0,002 = 0,142 (g) = 142 mg
Hàm lượng của khí clo trong không khí là: 142/20 = 7,1 (mg/m3)
Bài 21.11 trang 51 sách bài tập Hóa 10
Có 2 khí không màu, dễ tan trong nước, dung dịch thu được cho tác dụng với dung dịch AgNO3 tạo ra kết tủa màu vàng
a) Cho biết tên 2 khí đó.
b) Hãy phân biệt 2 khí đó bằng phương pháp hoá học.
Lời giải:
a) Hai khí đó là HBr và HI
HBr + AgNO3 → AgBr + HNO3
HI + AgNO3 → AgI + HNO3
b) Dẫn từng khí đó đi qua nước clo có pha sẵn hồ tinh bột, chất nào tạo ra chất mới có màu xanh là HI.
Cl2 + HI → 2HCl + I2
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 10 Bài 21: Khái quát về nhóm halogen (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 10 Bài 12: Liên kết ion - Tinh thể ion (chính xác nhất)
- Giải SBT Hóa học 10 Bài 29: Oxi - Ozon (chính xác nhất)
- Giải SBT Hóa học 10 Bài 11: Luyện tập (chính xác nhất)
- Giải SBT Hóa học 10 Bài 13: Liên kết cộng hóa trị (chính xác nhất)
- Giải SBT Hóa học 10 Bài 4: Cấu tạo vỏ nguyên tử (chính xác nhất)
- Giải SBT Hóa học 10 Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Giải SBT Hóa học 10 Bài 38: Cân bằng hóa học (chính xác nhất)
- Giải SBT Hóa học 10 Bài 36: Tốc độ phản ứng hóa học (chính xác nhất)