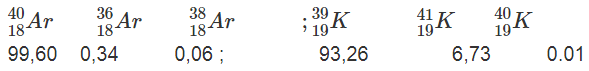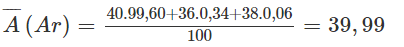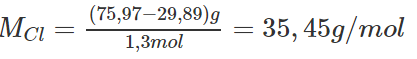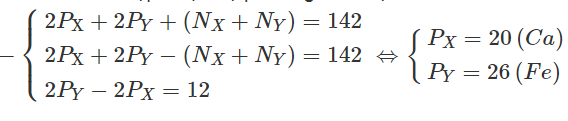Giải SBT Hóa học 10 Bài 3: Luyện tập: Thành phần nguyên tử (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 10 Bài 3: Luyện tập: Thành phần nguyên tử (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 10 Bài 3 SBT: Luyện tập: Thành phần nguyên tử
Bài 3.1 trang 8 sách bài tập Hóa 10
Liti trong tự nhiên có hai đồng vị :
7Li (có nguyên tử khối coi là bằng 7) chiếm 92,5% ;
6Li (có nguyên tử khối coi là bằng 6) chiếm 7,5%.
Nguyên tử khối trung bình của liti là
A. 7
B. 6,93
C. 6,07
D. 6
Lời giải:
Đáp án B
Bài 3.2 trang 8 sách bài tập Hóa 10
Phát biểu nào sau đây đúng
A. Chỉ có hạt nhân nguyên tử oxi mới có 8 nơtron
B. Chỉ có hạt nhân nguyên tử oxi mới có 8 electron
C. Chỉ có hạt nhan nguyên tử oxi mới có 8 proton
D. Chỉ có ion O2- mới có 10 electron
Lời giải:
Đáp án C
Bài 3.3 trang 8 sách bài tập Hóa 10
Kim loại M có số khối bằng 55. Tổng số các hạt cơ bản trong ion M2+ bằng 79. Kí hiệu nguyên tử của kim loại M là
Lời giải:
Hãy tính nguyên tử khối trung bình của liti.
Số khối = 55 ⇒ A = P + N = 55 (1)
Tổng số các hạt cơ bản trong ion M2+ bằng 79 ⇒ Tổng số các hạt cơ bản trong ion M bằng 81
⇒ P + N + E = 81 ⇒ 2P + N = 81 (2)
Từ (1)(2) ⇒ P = 26 = Z
Bài 3.4 trang 8 sách bài tập Hóa 10
Dưới đây là thành phần phần trăm của các đồng vị thuộc hai nguyên tố
Hãy tính nguyên tử khối trung bình của Ar và K (một cách gần đúng coi nguyên tử khối của các đồng vị trùng với số khối của chúng).
Trong trường hợp này hãy giải thích tại sao Ar có số đơn vị điện tích hạt nhân (số thứ tự) nhỏ hơn K mà lại có nguyên tử khối lớn hơn ?
Lời giải:
a) Nguyên tử khối trung bình của Ar :
Nguyên tử khối trung bình của K :
b) Trong trường hợp này ta thấy mặc dù Ar có số đơn vị điện tích hạt nhân hay số proton (Z = 18) nhỏ hơn K (Z = 19) nhưng lại có nguyên tử khối trung bình lớn hơn Kế
Sở dĩ như vậy là vì đồng vị nặng của Ar ( 40Ar) có thành phần tuyệt đối lớn (99,60%), trong khi đó, đồng vị nhẹ của K (39K) lại có thành phần tuyệt đối lớn (93,26%).
Bài 3.5 trang 9 sách bài tập Hóa 10
a) Khối lượng mol nguyên tử là gì ?
b) Hãy cho biết mối quan hệ giữa nguyên tử khối và khối lượng mol nguyên tử. Cho thí dụ cụ thể.
Lời giải:
a) Khối lượng mol nguyên tử (kí hiệu : MA) là khối lượng tính cho 1 mol nguyên tử
Khối lượng mol nguyên tử được định nghĩa theo hệ thức sau đây :
MA = m(g)/n(mol)
Trong đó, n là số mol (lượng chất) có khối lượng là m (tính ra gam).
Từ hệ thức trên ta dễ dàng thấy rằng khối lượng mol có đơn vị là g/mol.
b) Nguyên tử khối là số đo của khối lượng mol nguyên tử khi khối lượng mol nguyên tử tính ra g/mol.
Thí dụ : Nguyên tử khối của H là 1,008 thì khối lượng mol của H là 1,008 g/mol.
Bài 3.6 trang 9 sách bài tập Hóa 10
Khi điện phân 75,97 gam NaCl (muối ăn tinh khiết) nóng chảy người ta thu được 29,89 gam Na. Hãy xác định nguyên tử khối của clo (cho biết nguyên tử khối của natri bằng 22,99)
Lời giải:
Khối lượng mol nguyên tử của natri : MNa = 22,99 g/mol
Lương chất natri thu đươc: 29,89/22,99 = 1,3 mol
Vì trong phân tử NaCl số nguyên tử Na và số nguyên tử C1 như nhau nên khi điện phân 75,97 gam NaCl ta cũng thu được 1,3 mol nguyên tử clo.
Khối lượng mol nguyên tử clo sẽ là :
Vậy nguyên tử khối của clo là 35,45
Bài 3.7 trang 9 sách bài tập Hóa 10
Liti có 2 đồng vị : 7Li, 6Li
Clo có 2 đồng vị 35Cl, 37Cl
Hãy viết công thức của các loại phân tử liti clorua khác nhau.
Lời giải:
7Li35Cl
7Li37Cl
6Li35Cl
6Li37Cl
Bài 3.8 trang 9 sách bài tập Hóa 10
Tổng số hạt proton, nơtron, electron trong 2 nguyên tử kim loại X và Y là 142, trong đó tổng số hạt mang điện nhiều hơn tổng sô hạt không mang điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 12.Xác định hai kim loại X và Y.
Lời giải:
Kí hiệu : PX, PY và NX, NY lần lượt là số proton và số nơtron của nguyên tử X và Y.
Theo đề bài ta lập được hệ phương trình đại số :
Bài 3.9 trang 9 sách bài tập Hóa 10
Tổng số hạt proton, nơtron, electron trong nguyên tử của một nguyên tố là 34.
Biết rằng tỉ số N/Z (N là tổng số hạt nơtron, Z là tổng số hạt proton) của các nguyên tố có Z =1 đến Z = 20 có giá trị lớn nhất là 1,2.Xác định nguyên tử khối của nguyên tố.
Lời giải:
Z = số proton = số electron. N = số nơtron
Theo đề bài ta có : 2Z + N = 34
Ta biết rằng trong hạt nhân, số nơtron bao giờ cũng bằng hoặc lớn hơn số proton (trừ trường hợp duy nhất là hiđro có Z = 1).
N > Z. Vì vậy ta có : 3Z < 34, do đó Z < 34/3 = 11,3 (1)
Cũng vì N ≥ Z nên theo điều kiện của đề bài Z < 20, do đó :
N/Z ≤ 1,2 → N ≤ 1,2Z
Từ đó ta có : 2Z + N < 2Z + 1,2Z
34 < 3,2 => Z > 34/3,2 = 10,6 (2)
Tổ hợp (1) và (2) ta có : 10,6 < Z < 11,3 mà Z nguyên. Vậy Z = 11. Đó là nguyên tố natri có 11 proton, 11 electron, 12 nơtron.
Số khối của nguyên tử : A = Z + N = 23 => NTK là 23
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 10 Bài 3: Luyện tập: Thành phần nguyên tử (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 10 Bài 12: Liên kết ion - Tinh thể ion (chính xác nhất)
- Giải SBT Hóa học 10 Bài 29: Oxi - Ozon (chính xác nhất)
- Giải SBT Hóa học 10 Bài 11: Luyện tập (chính xác nhất)
- Giải SBT Hóa học 10 Bài 13: Liên kết cộng hóa trị (chính xác nhất)
- Giải SBT Hóa học 10 Bài 4: Cấu tạo vỏ nguyên tử (chính xác nhất)
- Giải SBT Hóa học 10 Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Giải SBT Hóa học 10 Bài 38: Cân bằng hóa học (chính xác nhất)
- Giải SBT Hóa học 10 Bài 36: Tốc độ phản ứng hóa học (chính xác nhất)