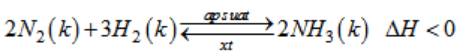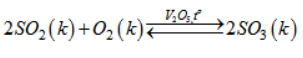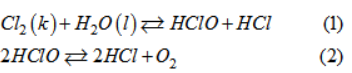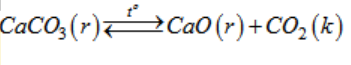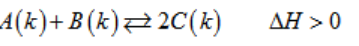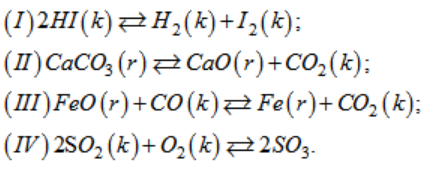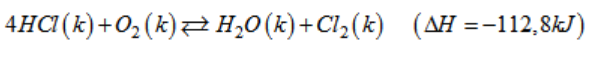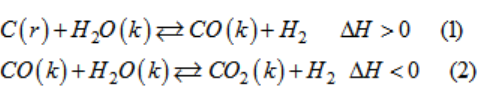Giải SBT Hóa học 10 Bài 38: Cân bằng hóa học (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn Giải SBT Hóa học 10 Bài 38: Cân bằng hóa học (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 10 Bài 38 SBT: Cân bằng hóa học
Bài 38.1 trang 82 sách bài tập Hóa 10
Cho PTHH:
N2(k) + O2(k) ↔ 2NO (k) ΔH > 0
Hãy cho biết những cặp yếu tố nào sau đây ảnh hường đến sự chuyển dịch cân bằng hóa học trên?
A. Nhiệt độ và nồng độ
B. Áp suất và nồng độ
C. Nồng độ và chất xúc tác
D. Chất xúc tác và nhiệt độ
Lời giải:
A
Bài 38.2 trang 82 sách bài tập Hóa 10
Sản xuất amoniac trong công nghiệp dựa trên phương trình hoá học sau :
Cân bằng hoá học sẽ chuyển dịch về phía tạo ra amoniac nhiều hơn, nếu
A. giảm áp suất chung của hệ.
B. giảm nồng độ của khí nitơ và khí hiđro.
C. tăng nhiệt độ của hệ.
D. tăng áp suất chung của hệ.
Lời giải:
D
Bài 38.3 trang 82 sách bài tập Hóa 10
Trong công nghiệp, để điều chế khí than ướt, người ta thổi hơi nước qua than đá đang nóng đỏ. Phản ứng hoá học xảy ra như sau :
Điều khẳng định nào sau đây là đúng ?
A. Tăng áp suất chung của hệ làm cân bằng không thay đổi.
B. Tăng nhiệt độ của hệ làm cân bằng chuyển sang chiều thuận.
C. Dùng chất xúc tác làm cân bằng chuyển sang chiều thuận.
D. Tăng nồng độ hiđro làm cân bằng chuyển sang chiều thuận.
Lời giải:
B
Bài 38.4 trang 82 sách bài tập Hóa 10
Câu nào sau đây đúng ?
A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hoá học
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hoá học.
D. Ở trạng thái cân bằng, khối lượng các chất ở 2 vế của phương trìnl phản ứng phải bằng nhau.
Lời giải:
C
Bài 38.5 trang 82 sách bài tập Hóa 10
Khi tăng áp suất không ảnh hưởng tới cân bằng của phản ứng nào sau đây ?
Lời giải:
C
Bài 38.6 trang 83 sách bài tập Hóa 10
Từ thế kỉ XIX, người ta đã nhận ra rằng trong thành phần khí lò cao (lò luyện gang) vẫn còn khí cacbon monoxit (CO). Người ta đã tìm đủ mẹ cách để phản ứng hoá học xảy ra hoàn toàn. Chẳng hạn tăng chiều cao củ lò, tăng nhiệt độ luyện gang,... Tuy nhiên khí lò cao vẫn còn CO Hãy cho biết nguyên nhân ?
Lời giải:
Phản ứng hoá học khử sắt oxit bằng cacbon monoxit là không hoàn toàn
Phản ứng tạo thành khí CO: C + O2 → CO2
C + CO2 → 2CO
Bài 38.7 trang 83 sách bài tập Hóa 10
Cho phương trình hoá học :
Cân bằng hoá học của phản ứng sẽ chuyển dịch về phía nào khi :
a) Tăng nhiệt độ của bình phản ứng ?
b) Tăng áp suất chung của hỗn hợp ?
c) Tăng nồng độ khí oxi ?
d) Giảm nồng độ khí sunfurơ ?
Lời giải:
a) Khi tăng nhiệt độ của bình phản ứng cân bằng hoá học của phản ứng sẽ chuyển dịch về phía nghịch, vì phản ứng thuận toả nhiệt.
b) Khi tăng áp suất chung của hỗn hợp, cân bằng hoá học của phản ứng sẽ chuyển dịch về chiều thuận vì sau phản ứng có sự giảm thể tích.
c) Khi tăng nồng độ khí oxi cân bằng hoá học của phản ứng sẽ chuyển dịch về phía thuận.
d) Khi giảm nồng độ khí sunfurơ cân bằng hoá học của phản ứng sẽ chuyển dịch về chiều nghịch.
Bài 38.8 trang 83 sách bài tập Hóa 10
Phản ứng hoá học sau đã đạt trạng thái cân bằng :
2NO2 ↔ N2O4 Δh < 0
Cân bằng hoá học sẽ chuyển dịch theo chiều nào khi
a) tăng nhiệt độ ?
b) tăng áp suất chung ?
c) thêm khí trơ agon và giữ áp suất không đổi ?
d) thêm chất xúc tác ?
Hãy giải thích sự lựa chọn đó.
Lời giải:
a) Khi tăng nhiệt độ, cân bằng hoá học của phản ứng sẽ chuyển sang chiều nghịch. Bởi vì phản ứng thuận toả nhiệt
b) Khi tăng áp suất chung, cân bằng hoá học của phản ứng sẽ chuyển sang chiều thuận. Bởi vì sau phản ứng thuận có sự giảm thể tích khí.
c) Khi thêm khí trơ agon và giữ áp suất không đổi thì nồng độ của hai khí đều giảm, tuy nhiên tốc độ phản ứng thuận sẽ giảm nhanh hom và do đó cân bằng hoá học của phản ứng sẽ chuyển sang chiều nghịch.
d) Thêm chất xúc tác không làm chuyển dịch cân bằng hoá học.
Bài 38.9 trang 84 sách bài tập Hóa 10
Clo tác dụng với nước một phần nhỏ theo PTHH sau :
Clo + H2O ↔ HCl + HClO
Hai sản phẩm tạo ra đều tan tốt trong nước tạo thành dung dịch. Ngoài ra, một phần lớn khí clo tan trong nước tạo thành dung dịch có màu vàng lục nhạt gọi là nước clo. Nước clo, đựng trong bình kín, dần dần bị mất màu theo thời gian, không bảo quản được lâu. Vận dụng những hiểu biết về chuyển dịch cân bằng hoá học, hãy giải thích hiện tượng trên
Lời giải:
Nước clo dần dần bị mất màu theo thời gian, không bảo quản được lâu là do quá trình phân huỷ HClO :
Phản ứng (2) làm cho nồng độ HClO giảm, cân bằng hoá học của phản ứng (1) chuyển dịch theo chiều thuận, clo sẽ phản ứng với nước cho đến hết, do đó nước clo không bền.
Bài 38.10 trang 84 sách bài tập Hóa 10
Sản xuất vôi trong công nghiệp và thủ công nghiệp đều dựa trên phản ứng hoá học :
Hãy phân tích các đặc điểm của phản ứng hoá học nung vôi.
Từ những đặc điểm đó, hãy cho biết những biện pháp kĩ thuật nào được sử dụng để nâng cao hiệu suất của quá trình nung vôi.
Lời giải:
a) Các đặc điểm của phản ứng hoá học nung vôi :
- Phản ứng thuận nghịch.
- Phản ứng thuận thu nhiệt.
- Phản ứng thuận có sản phẩm tạo thành là chất khí.
b) Những biện pháp kĩ thuật để nâng cao hiệu suất nung vôi:
- Chọn nhiệt độ thích hợp.
- Tăng diện tích tiếp xúc của chất rắn (CaCO3) bằng cách đập nhỏ đá vôi đến kích thước thích hợp.
- Thổi không khí nén (trong công nghiệp) hay chọn hướng gió thích hợp để tăng nồng độ khí oxi cung cấp cho phản ứng đốt cháy than, đồng thời làm giảm nồng độ khí cacbon đioxit.
Bài 38.11 trang 84 sách bài tập Hóa 10
Một phản ứng hoá học có dạng :
Hãy cho biết các biện pháp cần tiến hành để chuyển dịch cân bằng hoá học sang chiều thuận ?
Lời giải:
- Phản ứng trên không có sự thay đổi về số mol khí trước và sau phản ứng, do đó áp suất không có ảnh hưởng đến sự chuyển dịch cân bằng.
- Phản ứng thuận thu nhiệt, do đó tăng nhiệt độ làm cân bằng chuyển sang chiều thuận.
- Tăng nồng độ các chất A và B hay giảm nồng độ C cũng làm chuyển dịch cân bằng sang chiều thuận.
Bài 38.12 trang 84 sách bài tập Hóa 10
Cho các cân bằng sau :
Khi giảm áp suất của hệ, cân bằng nào bị chuyển dịch theo chiều nghịch ?
Lời giải:
Theo nguyên lý chuyển dịch cân bằng Lơ-sa-tơ-lie: khi giảm áp suất của hệ, cân bằng sẽ chuyển dịch theo chiều làm tăng áp suất của hệ → do đó chỉ có cân bằng (IV) là chuyển dịch theo chiều nghịch.
Bài 38.13 trang 85 sách bài tập Hóa 10
Những tác động nào sau đây có ảnh hưởng đến nồng độ của Cl2? Giải thích lí do.
a) Tăng nồng độ của O2.
b) Giảm áp suất của hệ.
c)Tăng nhiệt độ của bình phản ứng.
Lời giải:
a) Khi tăng nồng độ [O2] : cân bằng dịch chuyển theo chiều làm giảm [O2], tức là chiều thuận, chiều tạo ra Cl2, nên [Cl2] tăng.
b) Khi giảm áp suất : cân bằng dịch chuyển theo chiều làm tăng áp suất tức là chiều làm tăng số mol khí, đó là chiều nghịch, vì vậy [Cl2] giảm.
c) Khi nhiệt độ tăng, cân bằng dịch chuyển theo chiều thu nhiệt tức là chiều nghịch Vì phản ứng trên, chiều thuận có ∆H < 0 (là phản ứng toả nhiệt), nên [Cl2] giảm.
Bài 38.14 trang 85 sách bài tập Hóa 10
Xét các hệ cân bằng trong bình kín :
Các cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau :
a) Tăng nhiệt độ.
b) Thêm lượng hơi nước vào.
c) Lấy bớt H2 ra.
d) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
Lời giải:
a) (1) chiều thuận; (2) chiều nghịch.
b) (1) chiều thuận; (2) chiều thuận.
c) (1) chiều thuận; (2) chiều thuận.
d) (1) chiều nghịch; (2) không đổi.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 10 Bài 38: Cân bằng hóa học (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 10 Bài 12: Liên kết ion - Tinh thể ion (chính xác nhất)
- Giải SBT Hóa học 10 Bài 29: Oxi - Ozon (chính xác nhất)
- Giải SBT Hóa học 10 Bài 11: Luyện tập (chính xác nhất)
- Giải SBT Hóa học 10 Bài 13: Liên kết cộng hóa trị (chính xác nhất)
- Giải SBT Hóa học 10 Bài 4: Cấu tạo vỏ nguyên tử (chính xác nhất)
- Giải SBT Hóa học 10 Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Giải SBT Hóa học 10 Bài 38: Cân bằng hóa học (chính xác nhất)
- Giải SBT Hóa học 10 Bài 36: Tốc độ phản ứng hóa học (chính xác nhất)