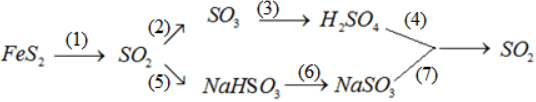Giải SBT Hóa học 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 10 Bài 32 SBT: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
Bài 32.1 trang 68 sách bài tập Hóa 10
Cho phản ứng: SO2 + 2H2S → 3S + 2H2O
Phát biểu nào sau đây đúng?
A. Lưu huỳnh bị oxi hoá và hiđro bị khử.
B. Lưu huỳnh bị khử và không có chất nào bị oxi hoá
C. Lưu huỳnh bị khử và hiđro bị oxi hoá
D. Lưu huỳnh trong SO2 bị khử, lưu huỳnh trong H2S bị oxi hóa
Lời giải:
Đáp án D
Bài 32.2 trang 68 sách bài tập Hóa 10
Oxit nào sau đây là hợp chất ion ?
A. SO2
B. SO3
C. CO2
D. CaO
Lời giải:
Đáp án D
Bài 32.3 trang 68 sách bài tập Hóa 10
Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử
A. H2SO4
B. H2S
C. SO2
D. SO3
Lời giải:
Đáp án C
Bài 32.4 trang 68 sách bài tập Hóa 10
Khí CO2 có lẫn tạp chất là SO2. Để loại bỏ tạp chất ta sụ hỗn hợp với dung dịch nào sau đây
A. Dung dịch Br2 dư
B. Dung dịch Ba(OH)2 dư
C. Dung dịch Ca(OH)2 dư
D. Dung dịch NaOH dư
Lời giải:
Đáp án A
Bài 32.5 trang 68 sách bài tập Hóa 10
Cho sơ đồ phản ứng
H2S + KMnO4 + H2SO4 → H2O + S + MnSO4 + K2SO4
Hệ số của các chất phản ứng là dãy số nào sau đây?
A. 3,3,5
B. 5,2,3
C. 2,2,5
D. 5,2,4
Lời giải:
Đáp án B
Bài 32.6 trang 69 sách bài tập Hóa 10
Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với 50 cm3 dung dịch loãng H2SO4 2M. PTHH của phản ứng :
Zn + H2SO4 → ZnSO4 + H2
Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm :
| Thí nghiệm | Kẽm | Nhiệt độ (oC) |
| 1 2 3 | bột lá lá | 30 20 30 |
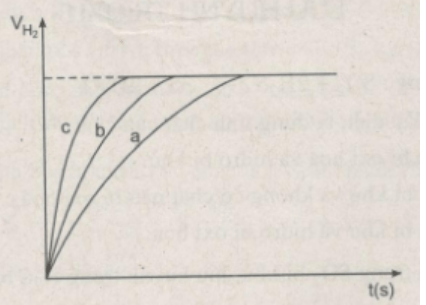
Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách nhất định về thời gian cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau :
a) Rút ra được những nhận xét gì khi so sánh hiện tượng phản ứng của :
- Thí nghiệm 1 và thí nghiệm 3 ?
- Thí nghiệm 2 và thí nghiệm 3 ?
b) Hãy quan sát đồ thị trên để cho biết các đường cong a, b, c biểu thị cho những thí nghiệm nào ?
c) Ghi thể tích khí H2 trên trục y khi phản ứng kết thúc. Biết rằng ở điều kiện phòng thí nghiệm, 1 mol khí có thể tích là 24 lít và Zn còn dư sau các thí nghiệm.
Lời giải:
a) Nhận xét:
- Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với H2SO4 ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau.
- Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch H2SO4 ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.
b) Đồ thị biểu diễn các phản ứng :
Đường cong c biểu diễn cho thí nghiệm 1, phản ứng xảy ra nhanh nhất
Đường cong b biểu diễn cho thí nghiệm 3, phản ứng xảy ra nhanh trung bình.
Đường cong a biểu diễn cho thí nghiệm 2, phản ứng xảy ra chậm nhất.
c) Thể tích khí hiđro :
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H2SO4 tham gia phản ứng
nH2 = nH2SO4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
VH2 = 0,1 x 24 = 2,4l = 2400 cm3
Ta ghi số 2400 cm3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).
Bài 32.7 trang 70 sách bài tập Hóa 10
Trong phòng thí nghiêm, bạn em khảo sát thí nghiệm dùng dung dịch HCL dư tác dụng với một khối lượng nhỏ FeS. Cứ sau một khoảng cách thời gian là 20 giây, bạn em lại ghi thể tích khí thoát ra. Kết quả ghi được như sau (xem bảng) :
| Thời gian (giây) | Thể tích H2S (cm3) | Thời gian (giây) | Thể tích H2S (cm3) |
| 0 20 40 60 80 | 0 27 49 68 83 | 100 120 140 160 180 | 93 99 100 100 100 |
a) Viết PTHH của phản ứng.
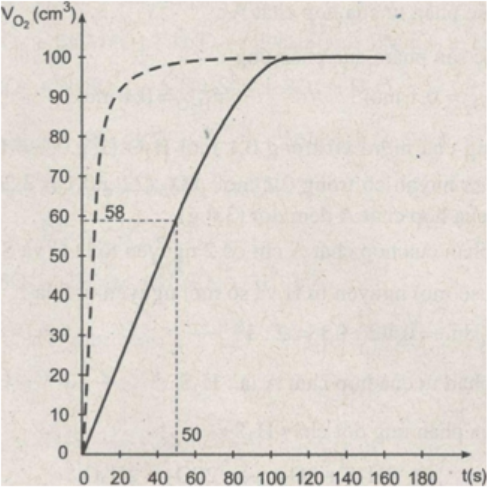
b) Vẽ đồ thị biểu diễn thể tích khí H2S thu được (trên trục tung) theo thời gian (trên trục hoành).
c) Hãy dùng đồ thị để tìm :
- Thể tích khí H2S thu được ở thời điểm 50 giây.
- Khoảng cách thời gian nào thì phản ứng xảy ra nhanh nhất ? chậm nhất ?
- Thời gian là bao nhiêu giây kể từ khi phản ứng xảy ra cho đến khi phản ứng kết thúc ?
d) Em hãy phác hoạ trên đồ thị này một đồ thị biểu diễn thể tích khí H2S thu được, nếu bạn em thay bằng dung dịch HCL khác có cùng thể tích nhưng có nồng độ cao hơn.
Lời giải:
a) PTHH: FeS + 2HCl → FeCl2 + H2
b) Đồ thị biểu diễn khí H2S sinh ra :
c) Căn cứ vào đồ thị, ta biết:
- Thể tích khí H2S thu được ở thời điểm 50 giây khoảng 58 cm3
- Trong, khoảng 20 giây đầu, phản ứng xảy ra nhanh nhất (đường cong có độ dốc lớn nhất). Khoảng thời gian 20 giây từ giây thứ 120 đến 140, phản ứng xảy ra chậm chất (đường cong có độ dốc nhỏ nhất).
- Phản ứng kết thúc ở giây thứ 140.
d) Nếu thay dung dịch HCl có nồng độ cao hơn thì đường cong sẽ có độ dốc lớn hơn, phản ứng sẽ kết thúc nhanh hơn, nhưng thể tích khí H2S hu được là không đổi. Trên đồ thị, đường cong này được biểu diễn bằng đường đứt nét.
Bài 32.8 trang 70 sách bài tập Hóa 10
Từ những chất sau : Cu, S, H2S, O2, Na2SO3, H2SO4 đặc và dung dịch H2SO4 loãng, hãy viết PTHH của phản ứng điều chế SO2
Lời giải:
Hướng dẫn. Các phản ứng điều chế
H2SO4 đặc tác dụng với Cu.
Cu + H2SO4 đặc → CuSO4 + SO2 + H2O
H2SO4 đặc tác dụng với S.
S + 2H2SO4 → 3SO2 + 2H2O
Đốt cháy S trong oxi hoặc trong không khí.
S + O2 → SO2
Đốt cháy H2S trong oxi hoặc trong không khí.
2H2S + 3O2 → 2SO2 + 2H2O
Dung dịch H2SO4 loãng tác dụng với Na2SO3 ở trạng thái rắn hoặc dung dịch.
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
Bài 32.9 trang 71 sách bài tập Hóa 10
Đốt cháy hoàn toàn 3,4 gam hợp chất A, thu được 2,24 lít khí SO2 (đktc) và 1,8 gam H2O
a) Hãy xác định công thức phân tử của hợp chất A.
b) Viết PTHH biểu diễn phản ứng cháy của hợp chất A.
c) Dẫn khí SO2 thu được ở trên vào 146,6 gam dung dịch, trong đó có hoà tan 0,3 mol NaOH. Hãy xác định nồng độ phần trăm các chất có trong dung dịch sau phản ứng.
Lời giải:
a) Công thức phân tử của hợp chất A :
Số mol các sản phẩm của phản ứng :
nSO2 = 0,1 mol; nH2O = 0,1 mol
Khối lượng của hiđro có trong 0,1 mol H2O (2 g.0,1 = 0,2 g) và khối lượng của lưu huỳnh có trong 0,1 mol SO2 (32 g.0,1 = 3,2 g) đúng bằng khối lượng của hợp chất A đem đốt (3,4 g).
Vậy thành phần của hợp chất A chỉ có 2 nguyên tố là H và S.
- Tỉ lệ giữa số mol nguyên tử H và số mol nguyên tử S là :
nH : nS = 0,1.2 : 0,1 = 2 : 1
Công thức phân tử của hợp chất A là : H2S
b) PTHH của phản ứng đốt cháy H2S
2H2S + 3O2 → 2H2O + 2SO2
c) Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol SO2 (0,1 mol) vậy sản phẩm là muối Na2SO3 . Ta có PTHH :
SO2 + 2NaOH → Na2SO3 + H2O
- Khối lượng của dung dịch sau phản ứng :
mdd = 146,6 + 3,4 = 150 (g)
- Khối lượng các chất có trong dung dịch sau phản ứng :
mNa2SO3 = 126.0,1 = 12,6g
mNaOH dư = 40.(0,3 - 0,2) = 4g
- Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C%Na2SO3 = 12,6/150 x 100% = 8,4%
C%NaOH dư = 4/150 x 100% = 2,67%
Bài 32.10 trang 71 sách bài tập Hóa 10
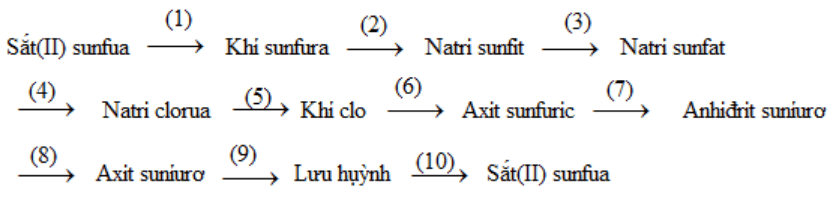
Viết phương trình hoá học của các phản ứng, hoàn thành chuỗi biến hoá sau :
Lời giải:
(1) 2Fe + 7/2 O2 to→ Fe2O3 + 2SO2
(2) SO2 + 2NaOH → Na2SO3 + H2O
(3) 3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
(4) Na2SO4 + BaCl2 → 2NaCl + BaSO4
(5) 2NaCl → 2Na + Cl2
(6) Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
(7) 2Fe + 6H2SO4 đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O
(8) SO2 + H2O → H2SO3
(9) H2SO3 + 2H2S → 3S + 3H2O
(10) Fe + S → FeS
Bài 32.11 trang 71 sách bài tập Hóa 10
Viết phương trình hoá học của các phản ứng, thực hiện chuỗi biến đổi sau
Lời giải:
(1) 4FeS2 + 11O2 to→ 2Fe2O3 + 8SO2
(2) 2SO2 + O2 to→ 2SO3
(3) SO3 + H2O → H2SO4
(4) Cu + 2H2SO4 đặc nóng → CuSO4 + SO2 + 2H2O
(5) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(6) Cu(OH)2 → CuO + H2O
(7) 2CuO → Cu2O + 1/2O2
(8) Cu2O + CO → 2Cu + CO2
(9) Cu + Ag2SO4 → CuSO4 + 2Ag
(10) 2CuSO4 → 2CuO + 2SO2 + O2
(11) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
(12) 2HBr → H2 + Br2
(13) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
Bài 32.12 trang 71 sách bài tập Hóa 10
Viết PTHH của chuỗi phản ứng sau :
Lời giải:
(1) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
(2) 2SO2 + O2 → 2SO3
(3) SO3 + H2O → H2SO4
(4) 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
(5) SO2 + NaOH → NaHSO3
(6) NaHSO3 + NaOH → Na2SO3 + H2O
(7) Na2SO3 + 2HCl → 2NaCl + H2O + CO2
Bài 32.13 trang 71 sách bài tập Hóa 10
a) Tại sao dung dịch H2S trong nước để lâu ngày trở nên vẩn đục ?
b) Hãy giải thích vì sao trong tự nhiên có nhiều nguồn phóng thải ra khí H2S (núi lửa, xác động vật bị phân huỷ) nhưng lại không có sự tích tụ khí đó trong không khí ?
c) Hãy giải thích vì sao các đồ vật bằng bạc để lâu ngày thường bị xám đen ?
d) Tại sao người ta có thể nhận biết khí H2S bằng tờ giấy tẩm dung dịch Pb(NO3)2
Lời giải:
a) Dung dịch H2S để lâu ngày bị vẩn đục do bị O2 trong không khí oxi hoá giải phóng ra không tan trong nước
2H2S + O2 → 2S + 2H2O
b) Do khí H2S có tính khử mạnh nên nó tác dụng luôn với các chất oxi hoá như O2 của không khí hoặc SO2 có trong khí thải của các nhà máy.
c) Do bạc tác dụng với O2 và khí H2S có trong không khí tạo ra bạc sunfua có màu xám đen.
4Ag + O2 + 2H2S → 2Ag2S + 2H2O
d) Nhận biết được khí H2S bằng dung dịch Pb(NO3)2 do phản ứng tạo ra chất kết tủa màu đen.
H2S + Pb(NO3)2 → PbS + 2HNO3
Bài 32.14 trang 72 sách bài tập Hóa 10
a) Viết PTHH của các phản ứng của H2S với O2, SO2, nước clo. Trong các phản ứng đó H2S hể hiện tính khử hay tính oxi hoá, vì sao ?
b) Có thể điều chế lưu huỳnh từ khí SO2 và H2S. Viết PTHH của phản ứng.
Lời giải:
a) 2H2S + 3O2 to→ 2SO2 + 2H2O
2H2S + SO2 → 3S + 2H2O
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Trong các phản ứng trên, H2S thể hiện tính khử.
b) 2H2S + SO2 → 3S + 2H2O
Bài 32.15 trang 72 sách bài tập Hóa 10
Trong phản ứng hoá học, các chất : S, H2S, SO2, H2SO3 có thể đóng vai trò chất oxi hoá hay chất khử ? Hãy viết PTHH của phản ứng để minh hoạ cho mỗi trường hợp.
Lời giải:
Các chất có thể đóng vai trò chất oxi hoá là S, SO2, H2SO3. Thí dụ
a) S + 2Na → Na2S
b) SO2 + 2H2S → 3S + 2H2O
c) H2SO3 + 2H2S to→ 3S + 3H2O
Các chất có thể đóng vai trò chất khử là S, H2S, SO2, H2SO3. Thí dụ
a) S + O2 to→ SO2
b) H2S + Cl2 → S + 2HCl
c) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
d) 5H2SO3 + 2KMnO4 → 2H2SO4 + K2SO4 + 2MnSO4 + 3H2O
Bài 32.16 trang 72 sách bài tập Hóa 10
Cho m gam hỗn hợp hai muối Na2CO3 và NaHCO3 có số mol bằng nhau tác dụng với dung dịch H2SO4 (loãng) dư. Khí sinh ra được dẫn vào dung dịch Ba(OH)2 dư thu được 41,4 gam kết tủa. Xác định m.
Lời giải:
Ta thấy: nCO2 = nSO2. Gọc XO2 = (CO2 + SO2)
=> X + 32 = (44+64)/2 => X = 22 (công thức tính PTK trung bình)
nBaXO3 = 0,2 mol
Khi đó: XO2 + Ba(OH)2 → BaXO3 + H2O
=> nCO2 = nSO2 = 0,1
nNa2CO3 = nNaHSO3 = 0,1 mol => m = 21g
Bài 32.17 trang 72 sách bài tập Hóa 10
Dẫn từ từ 28 gam hỗn hợp X gồm (CO2, SO2) (dX/O2 = 1,75) qua 500 ml dung dịch hỗn hợp (NaOH 0,7M ; Ba(OH)2 0,4M) được m gam kết tủa. Xác định m.
Lời giải:
Kí hiệu CO2 và SO2 là YO2 (MX = 56 → Y = 24)
nYO2 = 0,5 mol; ∑nOH- = 0,75 mol; nBa2+ = 0,2 mol
Ta có:
1 < nOH/nYO2 < = 1,5 < 2
=> Phản ứng tạo 2 muối HYO3- x mol; YO32- y mol
Ta có sơ đồ chuyển hóa :
YO32- + OH+ → HYO3- + YO32- (1)
YO32- + Ba2+ → BaYO3 (2)
Dựa vào mol YO2 và OH-
=> nYO32- = nHYO3- = 0,25
m = 0,2. (137 + 24 + 48) = 41,8g
Bài 32.18 trang 72 sách bài tập Hóa 10
Hấp thụ hết 3,35 lít khí SO2 (đktc) vào dung dịch NaOH thu được dung dịch X chứa 2 muối. Thêm Br2 vào dung dịch X, phản ứng xong thu được dung dịch Y. Cho dung dịch Y tác dụng với lượng dư dung dịch Ba(OH)2 thu được kết tủa. Tính khối lượng kết tủa thu được sau khi phản ứng xảy ra hoàn toàn.
Lời giải:
Ta thấy khi cho Br2 vào dung dịch 2 muối S4+ thì toàn bộ S4+ sẽ bị oxi hoá lên S6+ (SO42-)do đó :
nSO2 = nSO42- = 0,15
=> mBaSO4 = 0,15.233 = 34,95g
Bài 32.19 trang 72 sách bài tập Hóa 10
Hấp thu hoàn toàn 3,36 lít (đktc) hỗn hợp khí CO2 và SO2 vào 500 ml dung dịch NaOH có nồng độ a mol/l, thu được dung dịch X có khả năng hấp thụ tối đa 2,24 lít CO2. Xác định a.
Lời giải:
Kí hiệu CO2 và SO2 là YO2 => ∑nYO2 cần dùng = 0,25 mol
Chất tan sinh ra khi dung dịch NaOH hấp thụ tối đa YO2 sẽ là NaHYO3
YO2 + NaOH → NaHYO3
a = 0,25/0,5 = 0,5 (mol/l)
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 10 Bài 12: Liên kết ion - Tinh thể ion (chính xác nhất)
- Giải SBT Hóa học 10 Bài 29: Oxi - Ozon (chính xác nhất)
- Giải SBT Hóa học 10 Bài 11: Luyện tập (chính xác nhất)
- Giải SBT Hóa học 10 Bài 13: Liên kết cộng hóa trị (chính xác nhất)
- Giải SBT Hóa học 10 Bài 4: Cấu tạo vỏ nguyên tử (chính xác nhất)
- Giải SBT Hóa học 10 Bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học
- Giải SBT Hóa học 10 Bài 38: Cân bằng hóa học (chính xác nhất)
- Giải SBT Hóa học 10 Bài 36: Tốc độ phản ứng hóa học (chính xác nhất)