[ĐÁP ÁN] Liên kết hóa học trong phân tử HCl là?
Mời các em học sinh tham khảo câu hỏi trắc nghiệm hay, được chúng tôi sưu tầm có chọn lọc từ các bộ đề trắc nghiệm Hóa học lớp 10 của các trường THPT trên toàn quốc.
Trả lời câu hỏi: Liên kết hóa học trong phân tử HCl là
A. liên kết ion
B. liên kết cộng hóa trị phân cực
C. liên kết cho - nhận
D. liên kết cộng hóa trị không phân cực
Lời giải:
Đáp án đúng: B
Giải thích:
- Cấu hình e của H: 1s1 => thiếu 1 e để tạo cấu hình bên=> góp chung 1e
Cấu hình e của Cl: 1s22s22p63s23p5 => thiếu 1 e để tạo thành cấu hình bền => góp chúng 1 e
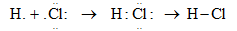
- Cặp e liên kết bị lệch về phía clo (clo có độ âm điện lớn hơn) => liên kết cộng hóa trị bị phân cực.
Vậy liên kết hóa học trong phân tử HCl là liên kết cộng hóa trị phân cực.
Kiến thức tham khảo
Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất
a, Sự hình thành phân tử HCl
- Cấu hình e của H: 1s1 => thiếu 1 e để tạo cấu hình bên=> góp chung 1e
Cấu hình e của Cl: 1s22s22p63s23p5 => thiếu 1 e để tạo thành cấu hình bền => góp chúng 1 e
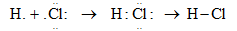
- Cặp e liên kết bị lệch về phía clo (clo có độ âm điện lớn hơn) => liên kết cộng hóa trị bị phân cực.
* Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía 1 nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
* Trong công thức electron của phân tử có cực, người ta đặt cặp electron chung lệch về phía kí hiệu của các nguyên tử có độ âm điện lớn hơn.
b, Sự hình thành phân tử khí cacbonic CO2 (có cấu tạo thẳng)
Cấu hình e của C: 1s22s22p2 => thiếu 4e để tạo cấu hình bền => góp chúng 4e
Cấu hình e của O: 1s22s22p4 => thiếu 2e để tạo thành cấu hình bền => góp chung 2e
Ta có:
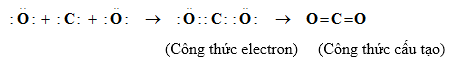
- Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng đạt cấu hình của khí hiếm nên phân tử CO2 bền vững.
* Cách viết công thức cộng hóa trị:
Bước 1: Xác định cấu hình electron các nguyên tử
Bước 2: Xác định số e thiếu để đạt cấu hình bền của khí hiếm => số e góp chung = số e thiếu
Bước 3: Viết công thức electron thỏa mãn quy tắc bát tử.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về [LỜI GIẢI] Liên kết hóa học trong phân tử HCl là? file tải PDF hoàn toàn miễn phí!
- [ĐÁP ÁN] Nguyên tố hóa học là tập hợp những nguyên tử có cùng?
- Giải Hoá học 10 Bài 37: Bài thực hành số 6 trang 155 SGK
- [ĐÁP ÁN] Liên kết hóa học trong phân tử HCl là?
- Soạn Hóa 10 Bài 21: Khái quát về nhóm Halogen đầy đủ nhất
- Báo cáo bài thực hành Hóa 10 Bài 20: Phản ứng oxi hóa khử chi tiết
- [ĐÁP ÁN] Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách?
- Giải Hoá học 10 Bài 39: Luyện tập trang 166, 167 SGK
- Giải SBT Hóa học 10 Bài 12: Liên kết ion - Tinh thể ion (chính xác nhất)