Bộ 3 đề kiểm tra giữa kì 1 môn Hóa lớp 10 năm 2021 (Có đáp án)
Kì thi giữa học kì 1 sắp tới, nhu cầu tìm kiếm nguồn tài liệu ôn thi chính thống có lời giải chi tiết của các em học sinh là vô cùng lớn. Thấu hiểu điều đó, chúng tôi đã dày công sưu tầm Bộ 3 đề thi giữa học kì 1 lớp 10 môn Hóa năm 2021 (Có đáp án) với nội dung được đánh giá có cấu trúc chung của đề thi giữa kì trên toàn quốc, hỗ trợ các em làm quen với cấu trúc đề thi môn Hóa lớp 10 cùng nội dung kiến thức thường xuất hiện. Mời các em cùng quý thầy cô theo dõi đề tại đây.
Đề thi Hóa 10 giữa học kì 1 năm 2021 - Đề số 1
(Trích đề kiểm tra giữa học kì 1 lớp 10 môn Hóa của trường THPT Phan Ngọc Hiển, Cà Mau)
Phần I: Trắc nghiệm (3 điểm)
Câu 1: Phát biểu nào sau đây không đúng?
A. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
B. Hầu hết các nguyên tử được cấu tạo từ các hạt cơ bản là p, n, e.
C. Hầu hết hạt nhân các nguyên tử cấu tạo bởi các hạt proton và hạt nơtron.
D. Vỏ nguyên tử được cấu tạo từ các hạt electron.
Câu 2: Cho ba nguyên tử có kí hiệu là 2412Mg, 2512Mg, 2612Mg. Phát biểu nào sau đây là sai?
A. Nguyên tố Mg có 3 đồng vị.
B. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Câu 3: Trong tự nhiên nitơ có hai đồng vị là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,7 B. 14,4 C. 14,0 D. 13,7
Câu 4: Một nguyên tử có cấu hình 1s22s22p3. Chọn phát biểu sai:
A. Nguyên tử đó có 7 electron.
B. Nguyên tử đó có 7 nơtron.
C. Không xác định được số nơtron.
D. Nguyên tử đó có 7 proton.
Câu 5: Lớp electron L có số phân lớp là:
A. 1
B. 2
C. 3
D. 4
Câu 6: Tổng số hạt trong nguyên tử của nguyên tố X là 40. Nguyên tử X có 3 electron ở lớp ngoài cùng. Số hiệu nguyên tử của X là:
A. 13
B. 12
C. 11
D. 31
Câu 7: Kí hiệu phân lớp nào sau đây là sai?
A. 2p
B. 3d
C. 4f
D. 2d
Câu 8: Cấu hình của phân lớp electron có mức năng lượng cao nhất của nguyên tử 20X là:
A. 3d2
B. 3p6
C. 3p4
D. 4s2
Câu 9: Tổng số hạt p, n, e trong nguyên tử nguyên tố A là 21. Vậy cấu hình electron của A là:
A. 1s2 2s2 2p4.
B. 1s2 2s2 2p2.
C. 1s2 2s2 2p3.
D. 1s2 2s2 2p5.
Câu 10: Một nguyên tử có kí hiệu là 4521X, cấu hình electron của nguyên tử X là:
A.1s2 2s2 2p6 3s2 3p6 4s2 3d1.
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d2.
C.1s2 2s2 2p6 3s2 3p6 3d3.
D. 1s2 2s2 2p6 3s2 3p6 3d1 4s2.
Câu 11: Cấu hình e nào sau đây của nguyên tử thuộc nguyên tố kim loại?
A. 1s22s22p1
B. 1s2s2s2p63s23p5
C. 1s22s22p63s23p3
D. 1s22s22p63s2
Câu 12: Một ion có 3p, 4n và 2e. Ion này có điện tích là
A. 3+
B. 2-
C. 1+
D. 1-
Phần II: Tự Luận (7 điểm)
Bài 1: (2 điểm)
Đồng có 2 đồng vị 6329Cu; 6529Cu, biết tỉ lệ số nguyên tử của chúng lần lượt là 105: 245. Tính nguyên tử khối trung bình của Cu?
Bài 2: (3 điểm)
Cho 2 nguyên tử 15A; 29B.
a/ Viết cấu hình electron của nguyên tử của nguyên tố A và B.
b/ Cho biết nguyên tử A, B thuộc loại nguyên tố họ s, p, d hay f? Vì sao?
c/ Cho biết nguyên tử A, B thuộc nguyên tố kim loại, phi kim hay khí hiếm? Vì sao?
Bài 3: (2 điểm). Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố X là 48. Số hạt mang điện bằng 5/3 lần số hạt không mang điện.
a/ Hãy xác định số lượng từng loại hạt trong nguyên tử của nguyên tố.
b/ Viết kí hiệu nguyên tử nguyên tố X.
c/ Cho biết nguyên tử có mấy lớp electron; số electron trên từng lớp.
Đáp án đề thi giữa kì 1 môn Hóa lớp 10 năm 2021 - Đề số 1
Phần I: Trắc nghiệm (3 điểm)
Mỗi câu trả lời đúng 0,25 điểm
| Câu hỏi | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| Đáp án | A | B | C | B | B | A | D | D | C | D | D | C |
Phần II: Tự Luận (7 điểm)
Câu 1
Gọi x, y lần lượt là phần trăm của 6329Cu; 6529Cu.
Ta có hệ phương trình 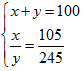
Giải hệ phương trình trên ta có
x = 30%
y = 70%
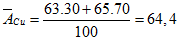
Câu 2
* 15A
a. Có 15 electron
1s22s22p63s23p3
b. A thuộc nguyên tố p.
Vì electron cuối cùng điền vào phân lớp p.
c. A là phi kim.
Vì có 5 electron lớp ngoài cùng.
* 29B
a. Có 29 electron
1s22s22p63s23p64s23d9
1s22s22p63s23p63d104s1
b. B thuộc nguyên tố d.
Vì electron cuối cùng điền vào phân lớp
c. B là kim loại.
Vì có 1 electron lớp ngoài cùng.
Câu 3:
Theo đề bài ta có hệ phương trình:
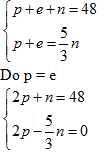
Giải hệ phương trình ta có p = 15; n = 18
a. Vậy:
Số proton = số elctron = 15
Số nơtron = 18
b. Ta có:
Z = p; N = n
A = Z + N = 15 + 18 = 33
c. Có 15 electron
1s22s22p63s23p3
Nguyên tử X có 3 lớp
Lớp 1(K) có 2e
Lớp 2(L) có 8e
Lớp 3(M) có 5e
Đề kiểm tra giữa kì 1 môn Hóa lớp 10 năm 2021 - Đề số 2
Cho: Na = 23, O = 16, C = 12, H = 1, Cu = 64, Fe = 56, S = 32, Br = 80
Khoanh tròn vào chữ cái đặt trước câu trả lời đúng nhất (0,4 điểm)
Câu 1. Nguyên tử được cấu từ các hạt cơ bản nào
A. proton, notron và electron
B. notron và electron
C. notron và proton
D. electron và notron
Câu 2. Phân lớp f chứa đối đa bao nhiêu electron
A. 10
B. 8
C. 6
D. 14
Câu 3. Trong tự nhiên thành phần phần trăm các đông vị kali là: 93,258% ; 0,012% và 6,730% . Nguyên tử khối trung bình của nguyên tố kali là:
A. 39,13484u
B. 38,13484u.
C. 37,13484u.
D. 39,63484u.
Câu 4. Nguyên tố hóa học là những nguyên tử có cùng
A. Số khối
B. số notron
C. số proton
D. số notron và số proton
Câu 5. Một nguyên tử M có 30 electron và 34 notron. Kí hiệu của nguyên tử M là
Câu 6. Nguyên tử Sn có kí hiệu hóa học . Số notron của nguyên tử là:
A. 50
B. 120
C. 70
D. 20
Câu 7. Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 5 electron. Số điện tích hạt nhân nguyên tử của nguyên tố X là:
A. 9
B. 16
C. 15
D. 17
Câu 8. Cấu hình electron của nguyên tử Kali (Z = 19) là
A.1s22s22p63s23p64s1
B.1s22s22p63s23p64s2
C.1s22s22p63s23p63d1
D. 1s22s22p63s23p53d2
Câu 9. Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là: 1s22s22p63s23p64s2
A. Ca
B. Cu
C. Ba
D. Mg
Câu 10. Nguyên tử R có điện tích hạt nhân là 13+. Trong nguyên tử R, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Hãy cho biết số khối của R.
A. 36R
B. 32R
C. 27R
D. 24R
Câu 11. Nguyên tử của một nguyên tố hóa học có bốn lớp electron, theo thứ tự từ phía gần hạt nhân là K, L ,M, N. Trong nguyên tử đã cho, electron thuộc lớp nào sau đây có mức năng lượng trung bình cao nhất?
A. Lớp K
B. Lớp L
C. Lớp M
D. Lớp N
Câu 12. Một nguyên tử có 20 proton và 20 nơtron trong hạt nhân. Điện tích của ion tạo thành khi nguyên tử này bị mất 2 electron là
A. 2+
B. 38+'
C. 22+
C. 22+
Câu 13. Lớp N có số electron tối đa là:
A. 4
B. 18
C. 16.
D. 32
Câu 14. Hợp chất RXa có tổng số p là 58. Trong hạt nhân M, số n nhiều hơn số p là 4. Trong hạt nhân X, số p bằng số n. Phân tử khối của RXa là
A. 112
B. 120
C. 46.
D. 128
Câu 15. Nguyên tử nguyên tố A có cấu hình e nguyên tử là 1s22s22p63s23p63d54s2. Phát biểu nào sau đây về nguyên tố A không đúng?
A. Cấu hình electron của ion A2+là [Ar]3d5.
B. Nguyên tử của A có 2 e hóa trị.
C. A là kim loại.
D. A là nguyên tố d.
Câu 16. Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố X là 21. Tổng số phân lớp electron trong nguyên tử của nguyên tố X là
A. 1
B. 2
C. 3
D. 4
Câu 17. X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. X là
A.O
B. S
C. Mg
D. P
Câu 18. Nguyên tố có cấu hình electron hóa trị 4s24p5 ở vị trí nào trong bảng tuần hoàn?
A. chu kì 4, nhóm VIA.
B. chu kì 4, nhóm VIIA.
C. chu kì 5, nhóm IIA.
D.chu kì 4, nhóm VIIB.
Câu 19. X và Y là 2 nguyên tố thuộc hai chu kỳ liên tiếp nhau trong cùng một nhóm A của bảng tuần hoàn, X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 32. Hai nguyên tố X và Y lần lượt là?
A. Na(Z=11) và K(Z=19).
B. Al(Z=13) và K(Z=19).
C. Mg(Z=12) và Ca(Z=20).
D. Mg(Z=12) và Ar(Z=18).
Câu 20. Dãy nguyên tử nào sau đây được xếp theo chiều bán kính nguyên tử tăng dần?
A. I, Br, Cl, F
B. Na, Mg, Al, Si
C. O, S, Se, Te
D. C, N, O, F.
Câu 21. Hợp chất khí với hidro của một nguyên tố có công thức tổng quát là MH4, oxit cao nhất của nguyên tố này chứa 53,3% oxi về khối lượng. Nguyên tố đó là
A. Si
B. Pb
C. C
D. Sn
Câu 22. Chu kì là tập hợp các nguyên tố mà nguyên tử của chúng có cùng
A. số electron lớp ngoài cùng.
B. số electron hóa trị.
C. số hiệu nguyên tử.
D. số lớp electron.
Câu 23. Nguyên tố hoá học Nhôm (Al) có số hiệu nguyên tử là 13, chu kỳ 3, nhóm IIIA. Điều khẳng định nào sau đây về Al là sai?
A. Hạt nhân nguyên tử Nhôm có 13 proton.
B. Số electron ở vỏ nguyên tử của nguyên tố đó là 13.
C. Nguyên tố hoá học này là một kim loại.
D. Vỏ nguyên tử có 3 lớp electron và lớp ngoài cùng có 2 electron.
Câu 24. Hòa tan hoàn toàn 11,2g một kim loại hóa trị II vào dung dịch HCl dư thu được 4,48 lít (đktc). Kim loại đó là:
A. Cu
B. Fe
C. Mg
D. Ba
Câu 25. Nguyên tố R có hợp chất khí với hidro là RH2. Hỏi R thuộc nhóm nào trong bảng tuần hoàn?
A. VIA
B. IVA
C. VIIA
D. IIA
Đáp án đề thi giữa học kì 1 lớp 10 môn Hóa năm 2021 - Đề số 2
| 1A | 2D | 3A | 4C | 5B |
| 6C | 7D | 8A | 9A | 10C |
| 11D | 12A | 13D | 14B | 15B |
| 16C | 17D | 18B | 19C | 20C |
| 21A | 22D | 23D | 24B | 25A |
Đề thi giữa học kì 1 lớp 10 môn Hóa năm 2021 - Đề số 3
Câu 1: Nguyên tử X và Y có hiệu số nguyên tử lần lượt là 19 và 15. Nhận xét nào sau đây đúng?
A. X và Y đều là phi kim.
B. X là 1 phi kim còn Y là 1 kim loại.
C. X là kim loại còn Y là phi kim.
D. X và Y đều là kim loại.
Câu 2: Sắp xếp các chất sau theo thứ trật tự tính bazơ tăng dần là
A. Al (OH)3, Mg(OH)2 , NaOH.
B. NaOH, Mg(OH)2 , Al(OH)3.
C. Mg (OH)2 ,Al(OH)3, NaOH.
D. NaOH, Al(OH)3 , Mg(OH)2.
Câu 3: Liên kết trong phân tử Cl2 là
A. Liên kết cộng hóa trị phân cực.
B. Liên kết ion.
C. Liên kết cho- nhận.
D. Liên kết cộng hóa trị không phân cực.
Câu 4: Cho cấu hình electron của các nguyên tử sau:
(X) 1s22s22p63s23p3
(Y) 1s22s22p63s23p64s1
(Z) 1s22s22p63s2
(T) 1s22s22p63s23p63d84s2
Dãy các cấu hình electron của các nguyên tử kim loại là
A. X, Y, Z.
B. Y, Z, T.
C. X, Y, Z.
D. X, Z, T.
Câu 5: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?
A. Giảm dần.
B. Giảm dần sau đó tăng dần.
C. Có sự thay đổi màu sắc của các chất.
D. Tăng dần.
Câu 6: Liên kết trong phân tử KCl là liên kết nào?
A. Liên kết cộng hóa trị phân cực.
B. Liên kết kim loại.
C. Liên kết ion.
D. Liên kết cộng hóa trị không phân cực.
Câu 7: Nguyên tố R có Z = 35, vị trí của R trong bảng tuần hoàn là
A.Chu kì 4, nhóm VIIA.
B. Chu kì 4, nhóm VB.
C. Chu kì 4, nhóm VA.
D. Chu kì 4, ,nhóm VIIB.
Câu 8: Chu kỳ là tập hợp các nguyên tố, mà nguyên tử của chúng có cùng?
A.Số electron ngoài cùng.
B.Tổng số electron.
C.Số lớp electron.
D.Số electron hóa trị.
Câu 9: Trong bảng tuần hoàn các nguyên tố, số chu kỳ nhỏ và chu kì lớn là
A. 4 và 4.
B. 3 và 3.
C. 3 và 4.
D. 4 và 3.
Câu 10: Nguyên tố X thuộc chu kỳ 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
A.1.
B. 3.
C. 4.
D. 2.
Câu 11: Hợp chất khí với Hiđro của một nguyên tố là RH4. Oxit cao nhất của nó có chứa 53,33% oxi về khối lượng. Nguyên tố đó là
A.C.
B. Si.
C. As.
D. Sb.
Câu 12: Cho 4,4g hỗn hợp 2 kim loại nhóm IIA thuộc hai chu kỳ liên tiếp với dung dịch HCl dư cho 3,36 lít khí (đktc). Hai kim loại là
A. Ca, Sr.
B. Be, Mg.
C. Mg, Ca.
D. Sr, Ba.
Câu 13: Độ âm điện là
A. Khả năng nhường electron của nguyên tử cho nguyên tử khác.
B. Khả năng tham gia phản ứng mạnh hay yếu.
C. Khả năng nhường proton của nguyên tử này cho nguyên tử khác.
D. Khả năng hút electron của nguyên tử trong phân tử.
Câu 14: Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p4. Số hiệu nguyên tử của X là?
A.14.
B.32.
C.16.
D.8.
Câu 15: Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết 79R chiếm 54,5%. Nguyên tử khối của đồng vị còn lại có giá trị là
A.80.
B.82.
C.81.
D.85.
Câu 16: Nguyên tố hóa học là gì?
A.Những nguyên tử có cùng số khối.
B.Những nguyên tử có cùng điện tích hạt nhân.
C.Những nguyên tử có cùng só electron, proton, nơtron.
D.Những nguyên tử có cùng số electron, nơtron.
Câu 17: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
A.27.
B. 23.
C. 28.
D. 26.
Câu 18: Ion nào sau đây là ion đa nguyên tử
A. S2-
B. Al3+
C. NH4+
D. Ca2+
Câu 19: Cation R+ có cấu hình e phân lớp ngoài cùng là 2p6. Liên kết giữa nguyên tử nguyên tố R với oxi thuộc loại liên kết gì?
A. Liên kết cộng hóa trị.
B. Liên kết ion.
C. Liên kết cộng hóa trị có cực.
D. Liên kết cho-nhận.
Câu 20: Nguyên tử các nguyên tố halogen được sắp xếp theo chiều bán kính nguyên tử giảm dần (từ trái sang phải) là
A. Br, I, Cl, F.
B. F, Cl, Br, I.
C. I, Br, F, Cl.
D. I, Br, Cl, F.
Câu 21: Phát biểu nào sau đây là không đúng?
A. Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
B. Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (từ He)
C. Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức R2O2.
D. Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A và 8 nhóm B.
Câu 22: Cacbon có 2 đồng vị: và . Oxi có 3 đồng vị: , , . Số phân tử CO khác nhau tạo được nên từ các đồng vị trên là
A. 4
B. 6
C. 10
D. 12
Câu 23. X và Y là hai nguyền tố thuộc hai chu kì liên tiếp nhau và cùng thuộc một nhóm A, trong đó X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 22. Xác định hai nguyên tố X, Y.
A. P và C.
B. O và S.
C. N và P.
D. F và Cl.
Câu 24. M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp kim loại và muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỷ khối của A so với khí hiđro là 11,5. Kim loại M là
A. Ca.
B. Mg.
C. Ba .
D. Be.
Câu 25. R thuộc chu kì 3 nhóm VA của bảng tuần hoàn. Cho biết cấu hình electron của R có bao nhiêu electron p ?
A. 3.
B. 4 .
C.9.
D. 6.
Đáp án đề kiểm tra giữa kì 1 môn Hóa lớp 10 năm 2021 - Đề số 3
Câu 1. C
Cấu hình electron nguyên tử X là: [Ar]4s1 → X có 1electron lớp ngoài cùng, vậy X là kim loại.
Cấu hình electron nguyên tử của Y là: [Ne]3s23p3 → Y có 5electron lớp ngoài cùng, vậy Y là phi kim.
Câu 2. A
Na, Mg và Al thuộc cùng một chu kỳ, ZNa < ZMg < ZAl. Vậy tính bazơ Al(OH)3 < Mg(OH)2 < NaOH.
Câu 3. D
Liên kết hình thành giữa 2 nguyên tử phi kim giống nhau là liên kết cộng hóa trị không phân cực.
Câu 4. B
X có 5 electron lớp ngoài cùng nên là phi kim → loại các đáp án A, C và D.
Câu 5. D
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit tăng dần.
Câu 6. C
Liên kết hình thành giữa kim loại điển hình và phi kim điển hình là liên kết ion.
Câu 7. A
Cấu hình electtron của R là 1s22s22p63s23p63d104s24p5
R có 4 lớp electron vậy R ở chu kỳ 4.
R có 7 electron lớp ngoài cùng, nguyên tố p, vậy R thuộc nhóm VIIA.
Câu 8. C
Các nguyên tố có cùng số lớp electron được xếp thành 1 chu kỳ.
Câu 9. C
Bảng tuần hoàn các nguyên tố hóa học gồm 3 chu kì nhỏ và 4 chu kì lớn.
Câu 10. B
Số lớp electron của X bằng số thứ tự chu kỳ và bằng 3.
Câu 11. B
Hợp chất khí với Hiđro của một nguyên tố là RH4 => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là RO2.
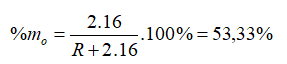
→ R = 28
Vậy R là Si (Silic).
Câu 12. C
Gọi công thức chung 2 kim loại M.
M + 2HCl → MCl2 + H2
Ta thấy: nKL = nH2 = 3,36 : 22,4 = 0,15 mol
MM = 4,4 : 0,15 = 29,33.
Có 24 (Mg) < MM < 40 (Ca)
Vậy hai kim loại đó là Mg và Ca.
Câu 13. D
Độ âm điện là đại lượng đặc trương cho khả năng hút electron của nguyên tử nguyên tử nguyên tố đó khi hình thành liên kết hóa học.
Câu 14. C
Số electron của X là 16 → Số hiệu nguyên tử X là 16.
Câu 15. C
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình:
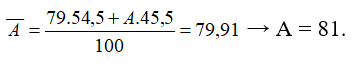
Câu 16. B
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
Câu 17. A
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Trong đó số p = số e.
-Tổng số hạt trong X bằng 40 nên 2p + n = 40 (1)
-Số hạt mang điện (p,e) nhiều hơn số hạt không mang điện (n) là 12 nên 2p –n =12 (2)
- Giải (1) và (2) thu được p =13 và n =14
Số khối A=13+14=27.
Câu 18. C
Ion đa nguyên tử là NH4+
Câu 19. B
Cấu hình electron của R là [Ne]3s1 → R là kim loại điển hình nhóm IA.
Liên kết hình thành giữa R (kim loại điển hình) và Oxi (phi kim điển hình) là liên kết ion.
Câu 20. D
Chiều giảm dần bán kính nguyên tử: I, Br, Cl, F.
Câu 21. C
Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức R2O7.
Câu 22. A
X và Y có cùng số proton.
Câu 23. B
Có 6 phân tử là: 12C16O; 12C17O; 12C18O; 13C16O; 13C17O; 13C18O;
Câu 24. C
Theo đề bài, ta có: ZX + ZY = 22 (1)
Nếu X, Y thuộc hai chu kì nhỏ thì (ZX < ZY): ZY = ZX + 8 (2)
Từ (1) và (2) => ZX =7; ZY = 15.
Vậy X là N, Y là P.
Nếu X thuộc chu kì nhỏ và Y thuộc chu kì lớn thì: ZY = ZX + 18 (3)
Từ (1) và (3) => ZX = 2; ZY = 20 (loại vì không thảo mãn đề bài).
Nếu X, Y thuộc hai chu kì lớn: ZY = ZX + 32 (4)
Từ (1) và (4) => ZX < 0 (loại).
Câu 25. B
Gọi số mol các chất trong hỗn hợp đầu: M = a mol; MCO3 = b mol.
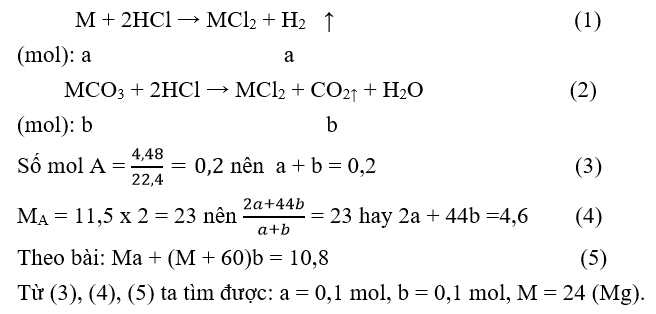
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Bộ 3 đề kiểm tra giữa kì 1 môn Hóa lớp 10 năm 2021 (Có đáp án) file Word, pdf hoàn toàn miễn phí!
- Đề thi Toán lớp 10 giữa kì 1 năm 2022 - 2023 THCS Lương Thế Vinh – Hà Nội
- Đề thi Toán lớp 10 giữa học kì 1 năm 2022 - 2023 THPT Nguyễn Hữu Huân - TP HCM
- Bộ đề thi giữa học kì 1 môn Toán lớp 10 phần 1 có lời giải chi tiết
- Đề thi giữa kì 1 Văn 10 2020 - Đề số 1 (Có đáp án)
- Đề cương ôn tập Toán 10 giữa học kì 1 năm 2022 - 2023 THPT Nguyễn Khuyến - Bình Dương
- 2 Bộ đề thi giữa học kì 1 lớp 10 môn Địa 2021 - Phần 1 (Có đáp án)
- Đề thi giữa kì 1 Văn 10 trường THPT Nguyễn Trãi 2020 (Có đáp án)
- 2 Bộ đề thi giữa kì 1 Văn 10 2021 - Phần 1 (Có đáp án)