Đề kiểm tra giữa kì 1 môn Hóa lớp 10 năm 2021 - Đề số 2 (Có đáp án)
Kì thi giữa học kì 1 sắp tới, nhu cầu tìm kiếm nguồn tài liệu ôn thi chính thống có lời giải chi tiết của các em học sinh là vô cùng lớn. Thấu hiểu điều đó, chúng tôi đã dày công sưu tầm Đề thi giữa học kì 1 lớp 10 môn Hóa năm 2021 - Đề số 2 (Có đáp án) với nội dung được đánh giá có cấu trúc chung của đề thi giữa kì trên toàn quốc, hỗ trợ các em làm quen với cấu trúc đề thi môn Hóa lớp 10 cùng nội dung kiến thức thường xuất hiện. Mời các em cùng quý thầy cô theo dõi đề tại đây.
Đề thi Hóa 10 giữa học kì 1 năm 2021 - Đề số 2
Câu 1. Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là
A. Liên kết ion.
B.Liên kết cộng hoá trị.
C.Liên kết kim loại.
D.Liên kết hiđro.
Câu 2. Liên kết hoá học giữa H và O trong phân tử H2O là liên kết
(Cho độ âm điện H và O lần lượt là 2,2 và 3,44)
A. cộng hoá trị không phân cực.
B. hiđro.
C. cộng hoá trị phân cực.
D. ion
Câu 3. Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
A. tăng theo chiều tăng của điện tích hạt nhân.
B. giảm theo chiều tăng của điện tích hạt nhân.
C. tăng theo chiều tăng của tính kim loại.
D. A và C đều đúng.
Câu 4. Tổng số hạt trong nguyên tử một nguyên tố R là 36. Số hạt mang điện gấp đôi hạt không mang điện. R là
A. 12Mg.
B. 20Ca.
C. 30Zn.
D. 13Al.
Câu 5. Nguyên tử các nguyên tố thuộc nhóm VA có số electron lớp ngoài cùng là
A. 4.
B. 3.
C. 5.
D. 1.
Câu 6. Cho nguyên tố X có số hiệu nguyên tử là 18, vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hoá học là
A. Ô số 18, chu kì 3, nhóm VIIIA.
B. Ô số 18, chu kì 3, nhóm VA.
C. Ô số 18, chu kì 4, nhóm IIA.
D. Ô số 18, chu kì 3, nhóm IIA.
Câu 7. Nguyên tố R thuộc nhóm VIA. Công thức oxit cao nhất của R và công thức hợp chất khí với hiđro của R là
A. R2O5 và RH .
B. RO2 và RH4.
C. R2O7 và RH.
D. RO3 và RH2.
Câu 8. Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Vị trí của nguyên tố R trong bảng tuần hoàn là vị trí nào sau đây
A. Ô số 23 chu kì 4 nhóm VB.
B. Ô số 25 chu kì 4 nhóm VIIB.
C. Ô số 24 chu kì 4 nhóm VIB.
D. tất cả đều sai.
Câu 9. Có những tính chất sau đây của nguyên tố:
(1) Hóa trị của nguyên tố trong hợp chất với oxi;
(2) Bán kính nguyên tử;
(3) Tính kim loại – phi kim;
(4) Tính axit – bazơ của hợp chất hiđroxit.
Trong các tính chất trên, số tính chất biến đổi tuần hoàn trong một nhóm A là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10. Tổng số các hạt proton, nơtron và electron trong nguyên tử của một nguyên tố là 40. Biết số hạt nơtron lớn hơn số hạt proton là 1. Cho biết nguyên tố trên thuộc loại nguyên tố nào?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d.
D. Nguyên tố f.
Câu 11. Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo thứ tự tăng dần từ trái sang phải là
A. Li, Na, O, F.
B. F, Na, O, Li.
C. F, O, Li, Na.
D. F, Li, O, Na.
Câu 12: Phát biểu nào sau đây là đúng?
A. Trong tất cả các nguyên tử, số proton bằng số nơtron.
B. Những nguyên tử có cùng số khối thuộc cùng một nguyên tố hóa học.
C. Hạt nhân của tất cả các nguyên tử đều có proton và nơtron.
D. Nguyên tố M có Z = 11 thuộc chu kì 3 nhóm IA.
Câu 13. Anion đơn nguyên tử Xn- có tổng số hạt mang điện là 18. Vị trí của nguyên tố X trong bảng tuần hoàn các nguyên tố hóa học là
A. Ô thứ 16, chu kỳ 3, nhóm VIA.
B. Ô thứ 9, chu kỳ 2, nhóm VIIA.
C. Ô thứ 17, chu kỳ 3, nhóm VIIA.
D. Ô thứ 8, chu kỳ 2, nhóm VIA.
Câu 14. Hai nguyên tử của nguyên tố X và Y có cấu hình electron ở lớp ngoài cùng là 4pa và 4sb. Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7. Biết X không phải là khí hiếm. Vậy Y và X lần lượt là
A. K và Br.
B. Ca và Br.
C. K và S.
D. Ca và S.
Câu 15. Chỉ ra nội dung sai khi nói về ion :
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 16: Trong tự nhiên Brom có hai đồng vị là 79Br và 81Br. Biết nguyên tử khối trung bình của Brom là 79,91. Phần trăm khối lượng đồng vị 81Br trong muối KBrO3 là ( biết Br (K = 39), O (M = 16))
A. 87, 02%.
B. 26,45%.
C. 22,08%.
D. 28,02%.
Câu 17: Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25, trong đó X có số proton nhở hơn Y. Hai nguyên tố X và Y lần lượt là
A. Mg và Al.
B. Al và Mg.
C. F và Cl.
D. Cl và F.
Câu 18: A, T là hai nguyên tố thuộc cùng một phân nhóm chính và ở hai chu kỳ liên tiếp nhau trong bảng BTTH, có tổng số hạt mang điện trong nguyên tử của A và T là 64 (trong đó zA < zT). Cấu hình electron của nguyên tử A và T lần lượt là
A. [Ne]3s2 và [Ar]4s2.
B. [Ar]3s2 và [Ne]4s2.
C. [He]2s22p3 và [Ar]3d104s2.
D. Cả A và C.
Câu 19: Cho 1,2 gam một kim loại thuộc nhóm IIA trong bảng HTTH tác dụng với HCl thu được 0,672 lít khí (đktc). Kim loại đó là
A. Be.
B. Mg.
C. Ca.
D. Ba.
Câu 20: Oxit cao nhất cuả nguyên tố R là RO2, trong hợp chất khí của R với hiđro có 25% hiđro về khối lượng. R là
A. C.
B. Si.
C. N.
D. S.
Câu 21: E là một nguyên tố có công thức hợp chất khí với H và oxit có hóa trị cao nhất của E lần lượt là: EHa và E2Ob có 2a + 3b = 21. % khối lượng của O trong hiđroxit có hóa trị cao nhất của E là 65,306%. Nguyên tố E là
A. Ni.
B. P.
C. S.
D. As.
Câu 22: Cho 8,5 gam hỗn hợp hai kim loại A, B thuộc hai chu kì liên tiếp ở nhóm IA vào nước thu được 3,36 lít khí H2. Hai kim loại A và B là
A. Li và Na.
B. Na và K.
C. Li và K.
D. K và Rb.
Câu 23: Cho các phát biểu sau về các nguyên tố nhóm A, hãy chọn phát biểu sai ?
A. Electron cuối cùng phân bố trên phân lớp s hoặc p.
B. Số thứ tự nhóm nhóm A bằng số electron ngoài cùng.
C. Electron hóa trị bằng electron ngoài cùng.
D. Electron cuối cùng phân bố trên phân lớp d hoặc f.
Câu 24: Tổng số electron trong ion 17Cl− là:
A. 17.
B. 36.
C. 35.
D. 18.
Câu 25: Trong bảng tuần hoàn, nguyên tố có tính phi kim mạnh nhất là
A. O (oxi).
B. F (flo).
C. Cl (clo).
D. Na (natri).
Câu 26: Cation M+ có cấu hình electron 1s22s22p6. Vậy M là nguyên tố:
A. Ở chu kỳ 3, nhóm IIIA.
B. Ở chu kỳ 2, nhóm IIIA.
C. Ở chu kỳ 3, nhóm IA.
D. Ở chu kỳ 2, nhóm IIA.
Câu 27: Trong số các nguyên tử sau, chọn nguyên tử có số nơtron nhỏ nhất.
A. 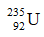 .
.
B. 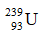 .
.
C. 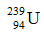 .
.
D. 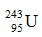 .
.
Câu 28: Cho biết nguyên tố A ở chu kì 3, nhóm VIIA. Cấu hình electron của A là
A. 1s22s22p63s23p5.
B. 1s22s22p63s23p8.
C. 1s22s22p63s23p6.
D. 1s22s22p63s23p4.
Câu 29: Tính chất nào sau đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân?
A. Hóa trị cao nhất với oxi.
B. Tính kim loại và tính phi kim.
C. Nguyên tử khối.
D. Số electron ở lớp ngoài cùng.
Câu 30: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
A. kim loại và kim loại.
B. kim loại và khí hiếm.
C. phi kim và kim loại.
D. khí hiếm và kim loại.
Đáp án đề kiểm tra giữa kì 1 môn Hóa lớp 10 năm 2021 - Đề số 2
Câu 1. B
Câu 2. C
Nguyên tử oxi có độ âm điện lớn hơn nhiều so với nguyên tử hiđro.
Ngoài ra, xét liên kết H – O, có hiệu độ âm điện 1,24
→ Liên kết cộng hóa trị phân cực
Câu 3. D
Câu 4. A
Gọi số proton, nơtron và electron của R lần lượt là p, n và e.
Ta có:
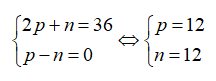
Vậy R là Mg.
Câu 5. C
Số electron lớp ngoài cùng = STT nhóm A = 5.
Câu 6. A
Cấu hình electron nguyên tử X: 1s22s22p63s23p6
X ở ô số 18 (z = 18), chu kỳ 3 (có 3 lớp e), nhóm VIIIA (8 electron lớp ngoài cùng, nguyên tố p).
Câu 7. D
R thuộc nhóm VIA → Hóa trị của R trong oxit cao nhất là VI, hóa trị của R trong hợp chất khí với H là II.
→ Công thức oxit cao nhất của R và công thức
hợp chất khi với hiđro lần lượt là RO3 và RH2.
Câu 8. A
Cấu hình electron của nguyên tử R là: 1s22s22p63s23p63d34s2
R thuộc chu kỳ 4 do có 4 lớp electron, nhóm VB do 5 electron hóa trị và nguyên tố d. Nguyên tử R có 23 electron vậy R thuộc ô số 23.
Câu 9. C
Trong một nhóm A, các tính chất 1, 3, 4 biến đổi tuần hoàn .
Câu 10. B
Giả sử số proton, số nơtron, số electron của nguyên tố trên lần lượt là p; n và e.
Trong đó: p =e =z.
Ta có hpt: 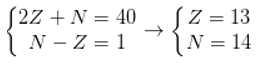
Cấu hình electron của nguyên tố là: 1s22s22p63s23p1
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p
Câu 11. C
Ta có:
Li: [He]2s1 → Li ở chu kỳ 2, nhóm IA.
O: [He]2s22s4→ O ở chu kỳ 2, nhóm VIA.
F: [He]2s22s5→ F ở chu kỳ 2, nhóm VIIA.
Na: [He]3s1 → Na ở chu kỳ 3, nhóm IA.
Có Li và Na ở cùng nhóm IA, ZNa > ZLi nên bán kính nguyên tử Na > Li.
Có Li, O và F cùng thuộc chu kỳ 2, ZLi > ZO > ZF nên bán kính nguyên tử Li > O > F.
Chiều tăng bán kính nguyên tử là: F < O < Li < Na.
Câu 12. D
A sai vì trong nguyên tử, số p = số e.
B sai vì nguyên tử có cùng số proton thuộc cùng nguyên tố hóa học.
C sai vì không phải nguyên tử nào cũng có số p = số n.
D đúng vì M có cấu hình electron nguyên tử: [Ne]3s1 nên thuộc chu kỳ 3, nhóm IA.
Câu 13. D
Vì X có Z < 18 : 2= 9
Câu 14. B
X và Y có cấu hình electron ở lớp ngoài cùng là 4pa và 4sb
a + b = 7.
Mà X không phải là khí hiếm → a = 5, b = 2.
Cấu hình electron của X là 1s22s22p63s23p63d104s24p5
→ X có số hiệu nguyên tử = số electron = 35 → X là Br.
Cấu hình electron của Y là 1s22s22p63s23p64s2
→ Y có số hiệu nguyên tử = số electron = 20 → Y là Ca.
Câu 15. B
Ion âm gọi là anion, ion dương gọi là cation.
Câu 16. C
Gọi % số nguyên tử của mỗi đồng vị 79Br và 81Br là x và y. Ta có:
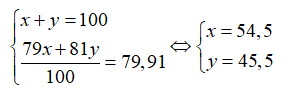
Giả sử có 1 mol KBrO3, số mol 81Br = 0,455 mol
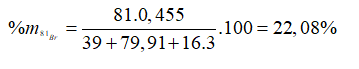
Câu 17. A
Gọi số proton của X và Y lần lượt là px và Py.
Theo bài ra ta có:
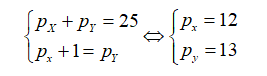
Vậy X là Mg còn Y là Al.
Câu 18. A
Tổng số hạt mang điện trong A và T là 64 nên:
2ZA + 2ZT = 64 → ZA + ZT = 32 (1). Vậy A và T thuộc các chu kỳ nhỏ
hay ZA + 8 = ZT (2)
Từ (1) và (2) → ZA = 12 và ZT = 20.
Vậy cấu hình electron nguyên tử của A và T lần lượt là: [Ne]3s2 và [Ar]4s2.
Câu 19. C
Gọi kim loại cần tìm là M
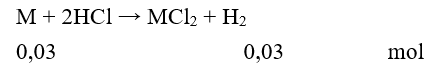
Vậy MM = 1,2 : 0,03 = 40. Do đó M là Ca.
Câu 20. A
Oxit cao nhất của R là RO2 nên R thuộc nhóm IVA. Công thức hợp chất khí của R là RH4.
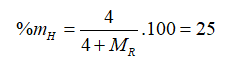
→MR = 12. Vậy R là C.
Câu 21. B
Từ công thức oxit cao nhất và công thức hợp chất khí với H ta có: a + b = 8.
Theo bài ra: 2a + 3b = 21
→ a = 3 và b = 5.
Vậy E thuộc nhóm VA.
Trường hợp 1: Công thức hiđroxit tương ứng của E là: H3EO4
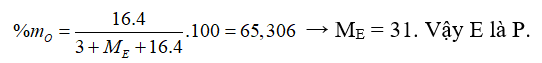
Trường hợp 2: Công thức hiđroxit tương ứng là HEO3
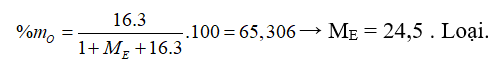
Câu 22. B
Đặt hai kim loại tương ứng với một kim loại là M
(giả sử MA < MB → MA < MM < MA)
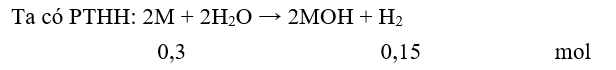
MM = 8,5 : 0,3 = 28,33. Vậy hai kim loại là Na (M = 23) và K (M = 39).
Câu 23. D
Câu 24. D
Trong nguyên tử Cl, số e = số p = z = 17.
Ta có: Cl + 1e → Cl-
Vậy số electron của Cl- là 17 + 1 = 18.
Câu 25. B
Phi kim mạnh nhất là Flo (F).
Câu 26. C
M → M+ + 1e
Vậy cấu hình e của M là 1s22s22p63s1. Do đó M ở chu kỳ 3, nhóm IA.
Câu 27. A
A: số n = 235 – 92 = 143
B: số n = 239 – 93 = 146
C: số n = 239 – 94 = 145.
D: số n = 243 – 95 = 148.
Câu 28. A
A ở chu kỳ 3 nên có 3 lớp electron; A thuộc nhóm VIIA nên số electron lớp ngoài cùng là 7.
Cấu hình electron của A là 1s22s22p63s23p5.
Câu 29. C
Câu 30. C
Ta có cấu hình electron của Y là 1s22s22p63s23p64s1 → Y là kim loại.
Cấu hình electron của X là 1s22s22p63s23p5 → X là phi kim.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Đề thi giữa học kì 1 lớp 10 môn Hóa năm 2021 - Đề số 2 (Có đáp án) file Word, pdf hoàn toàn miễn phí!
- Đề thi Toán lớp 10 giữa kì 1 năm 2022 - 2023 THCS Lương Thế Vinh – Hà Nội
- Đề thi Toán lớp 10 giữa học kì 1 năm 2022 - 2023 THPT Nguyễn Hữu Huân - TP HCM
- Bộ đề thi giữa học kì 1 môn Toán lớp 10 phần 1 có lời giải chi tiết
- Đề thi giữa kì 1 Văn 10 2020 - Đề số 1 (Có đáp án)
- Đề cương ôn tập Toán 10 giữa học kì 1 năm 2022 - 2023 THPT Nguyễn Khuyến - Bình Dương
- 2 Bộ đề thi giữa học kì 1 lớp 10 môn Địa 2021 - Phần 1 (Có đáp án)
- Đề thi giữa kì 1 Văn 10 trường THPT Nguyễn Trãi 2020 (Có đáp án)
- 2 Bộ đề thi giữa kì 1 Văn 10 2021 - Phần 1 (Có đáp án)