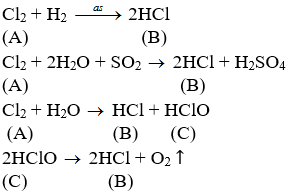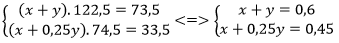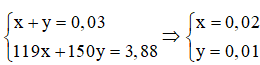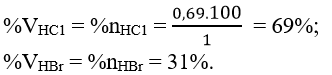Soạn Hóa học 10 nâng cao Bài 37: Luyện tập chương 5
Với bộ tài liệu giải bài tập SGK Hóa 10 nâng cao Bài 37: Luyện tập chương 5, hướng dẫn cách giải chi tiết cho từng câu hỏi, từng phần học bám sát nội dung chương trình sách giáo khoa bộ môn Hóa nâng cao lớp 10. Nội dung chi tiết các em xem tại đây.
Giải bài 1 trang 149 SGK Hóa lớp 10 nâng cao
Đổ dung dịch AgNO3 lần lượt vào 4 dung dịch: NaF, NaCl, NaBr, và NaI thì thấy hiện tượng gì xảy ra?
A. Cả 4 dung dịch đều tạo ra kết tủa.
B. Có 3 dung dịch tạo ra kết tủa và 1 dung dịch không tạo kết tủa.
C. Có 2 dung dịch tạo ra kết tủa và 2 dung dịch không tạo kết tủa.
D. Có 1 dung dịch tạo ra kết tủa và 3 dung dịch không tạo kết tủa.
Tìm phương án đúng.
Lời giải:
Chọn B
AgF là muối tan nên chỉ có 3 dung dịch xảy ra phản ứng tạo kết tủa
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + NaBr → AgBr↓ + NaNO3
AgNO3 + NaI → AgI↓ + NaNO3
Giải bài 2 trang 149 SGK Hóa lớp 10 nâng cao
Có ba bình không ghi nhãn, mỗi bình đựng một trong các dung dịch NaCl, NaBr và NaI. Chỉ dùng hai thuốc thử (không dùng AgNO3), làm thế nào để xác định dung dịch chứa trong mỗi bình? Viết phương trình hóa học.
Lời giải:
Trích mỗi dung dịch một ít làm mẫu thử và cho một ít hồ tinh bột vào 3 mẫu thử trên, tiếp tục cho nước clo lần lượt vào 3 mẫu thử.
- Mẫu thử chuyển sang vàng là mẫu NaBr.
Cl2 + 2NaBr → 2NaCl + Br2
- Mẫu thử có xùất hiện màu xanh là mẫu NaI. Do I2 sinh ra làm xanh hồ tinh bột
Cl2 + 2NaI → 2NaCl + I2
- Mẫu không có hiện tượng là NaCl.
Giải bài 3 trang 149 SGK Hóa lớp 10 nâng cao
Hãy cho biết tên của các chất A, B, C biết rằng chúng tham gia các phản ứng được ghi bằng các sơ đồ sau. Biết A là chất khí ở điều kiện tiêu chuẩn.
A + H2 -> B;
A + H2O + SO2 -> B + …
A + H2O ⇌ B + C;
C -> B + …
Hãy viết phương trình hóa học đầy đủ của các phản ứng.
Lời giải:
Phương trình phản ứng:
Giải bài 4 trang 149 SGK Hóa lớp 10 nâng cao
Chia một dung dịch nước brom có màu vàng thành hai phần. Dẫn khí A không màu đi qua phần một thì dung dịch mất màu. Dẫn khí B không màu đi qua phần hai thì dung dịch sẫm màu hơn.
Hãy cho biết khí A, khí B có thể là những chất gì? Viết các phương trình hóa học.
Lời giải:
Khí A: SO2; Khí B : HI
Phần 1: SO2 + Br2+ 2H2O → 2HBr + H2SO4
Phần 2: Br2 + 2HI → 2HBr + I2↓
Giải bài 5 trang 149 SGK Hóa lớp 10 nâng cao
Brom có lẫn ít tạp chất là clo. Làm thế nào để thu được brom tinh khiết. Viết phương trình hóa học.
Lời giải:
Cho một ít NaBr vào hỗn hợp để loại khí Cl2
Cl2 + 2NaBr -> 2NaCl + Br2
Chưng cất hỗn hợp để lấy Br2 tinh khiết.
Giải bài 6 trang 150 SGK Hóa lớp 10 nâng cao
Bằng thí nghiệm nào có thể kiểm tra được khí nitơ có lẫn tạp chất sau đây hay không?
a) Clo.
b) Hiđro clorua.
Hãy viết các phương trình hóa học.
Lời giải:
a) Cho hỗn hợp khí qua dung dịch KI, nếu thấy dung dịch chuyển sang màu nâu thì hỗn hợp có lẫn Cl2:
Cl2 + 2KI -> 2KCl + I2
b) Cho hỗn hợp qua dung dịch AgNO3 nếu có kết tủa trắng là hỗn hợp có HCl:
HCl + AgNO3 -> AgCl↓ + HNO3.
Giải bài 7 trang 150 SGK Hóa lớp 10 nâng cao
Cho các chất: brom, clo, hiđro clorua, iot, bạc bromua, natri clorua. Hãy chọn trong số các chất trên.
a) Một chất lỏng ở nhiệt độ phòng.
b) Một chất có trong nước biển nhưng không có trong nước nguyên chất.
c) Một chất khí màu vàng lục.
d) Một chất bị phân hủy bởi ánh sáng mặt trời.
e) Một chất khí không màu tạo “khói” trong không khí ẩm.
f) Một hợp chất được dùng để bảo quản thực phẩm.
Lời giải:
a) Brom.
b) Natri clorua.
c) Clo.
d) Bạc bromua.
e) Hiđro clorua.
f) Natri clorua.
g) Clo.
h)iot.
i)Clo.
Giải bài 8 trang 150 SGK Hóa lớp 10 nâng cao
Khi bị nung nóng, kali clorat đồng thời phân hủy theo hai cách:
a) Tạo ra oxi và kali clorua;
b) Tạo ra kali peclorat và kali clorua.
- Viết các phương trình hóa học.
- Tính xem có bao nhiêu phần trăm về khối lượng kali clorat đã phân hủy theo phản ứng (a) và phản ứng (b), biết rằng khi phân hủy 73,5gam kali clorat, thu được 33,5gam kali clorua.
Lời giải:
Phản ứng hóa học xảy ra:
Phương trình hóa học:
2KClO3 -to→ 2KCl + 3O2 (a)
x → x
4KClO3 -to→ 3KClO4 + KCl (b)
y → 0,25y
Phần trăm khối lượng KClO3 đã bị phân hủy.
Theo pt: nKCl (a) = nKClO3 = x mol
nKCl (b) = 1/4. nKClO3 = 0,25.y mol
Theo đề bài, ta có:
Giải được x = 0,4; y = 0,2.
Phần trăm khối lượng KClO3 phân hủy theo (a): [(0,4 x 122,5)/73,5]. 100% = 66,67%
Phần trăm khối lượng KClO3 phân hủy theo (b): [(0,2 x 122,5)/73,5]. 100% = 33,33%
Giải bài 9 trang 150 SGK Hóa lớp 10 nâng cao
Thêm 78ml dung dịch bạc nitrat 10% (khối lượng riêng 1,09 g/ml) vào một dung dịch có chứa 3,88g hỗn hợp kali bromua và natri iotua. Lọc bỏ kết tủa. Nước lọc phản ứng vừa đủ với 13,3 ml dung dịch axit clohiđric nồng độ 1,5 mol/1. Hãy xác định thành phần phần trăm khối lượng từng chất trong hỗn hợp muối ban đầu và tính thể tích hiđro clorua ở điều kiện tiêu chuẩn cần dùng để tạo ra lượng axit clohiđric đã dùng.
Lời giải:
Số mol AgNO3 = (78.1,09.10)/(100.170) = 0,05 (mol);
Số mol HCl = 0,0133.1,5 = 0,02 (mol)
Đặt số mol của KBr và NaI lần lượt là x mol và y mol.
AgNO3 + KBr → AgBr↓ + KNO3 (1)
x ← x x
AgNO3 + NaI → AgI↓ + NaNO3 (2)
y ← y y
AgNO3 + HCl → AgCl↓ + HNO3 (3)
0,02 ← 0,02 0,02
Gọi số mol của KBr và NaI lần lượt là x mol và y mol
Theo pt: nAgNO3 = x + y + 0,02 = 0,05 mol
Theo đề bài: mKBr + mNaI = 119x + 150y = 3,88
Theo đề bài, ta có hệ phương trình:
Vậy %mKBr = [(0,02.119)/3,88]. 100% = 61,34%
%mNaI = 100% - 61,34% = 38,66%
Thể tích hidro clorua cần dùng:
0,02.22,4 = 0,448 (lít).
Giải bài 10 trang 150 SGK Hóa lớp 10 nâng cao
Hòa tan hoàn toàn hỗn hợp khí gồm hiđro clorua và hiđro bromua vào nước, ta thu được dung dịch chứa hai axit với nồng độ phần trăm bằng nhau. Hãy tính thành phần phần trăm theo thể tích của từng chất trong hỗn hợp khí ban đầu.
Lời giải:
Đặt số mol của HCl và HBr lần lượt là x mol và y mol. Thành phần phần trăm của các chất trong hỗn hợp về mặt toán học không phụ thuộc vào số mol hỗn hợp. Nên trong trường hợp này ta xét số mol hỗn hợp là 1 mol.
=> x + y = 1 (*)
Dung dịch chứa 2 axit có nồng độ phần trăm bằng nhau có nghĩa là khối lượng 2 axit bằng nhau.
=> 36,5x = 81 y (**) .
Giải hệ (*) và (**) ta được x = 0,69 và y = 0,31 Thành phần phần trăm thể tích của từng chất khí trong hỗn hợp
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về giải bài tập SGK Hóa học lớp 10 nâng cao Bài 37: Luyện tập chương 5, file PDF hoàn toàn miễn phí.
- Soạn Hóa học 10 nâng cao Bài 36: Iot chính xác nhất
- Soạn Hóa học 10 nâng cao Bài 34: Flo (Chính xác nhất)
- Soạn Hóa học 10 nâng cao Bài 37: Luyện tập chương 5
- Soạn Hóa học 10 nâng cao Bài 35: Brom (Chính xác nhất)
- Soạn Hóa học 10 nâng cao Bài 32: Hợp chất có oxi của clo
- Soạn Hóa học 10 nâng cao Bài 31: Hiđro clorua - Axit clohiđric
- Soạn Hóa học 10 nâng cao Bài 30: Clo (Chính xác nhất)
- Soạn Hóa học 10 nâng cao Bài 29: Khái quát về nhóm halogen