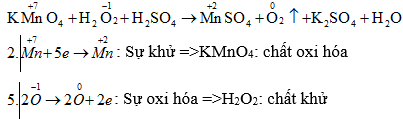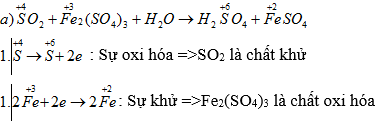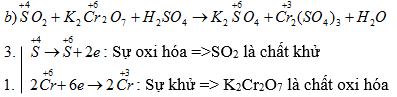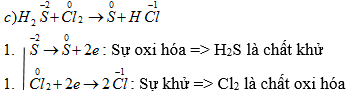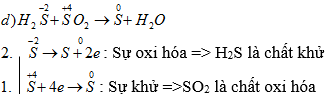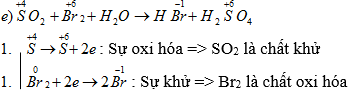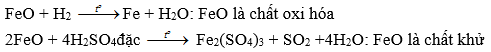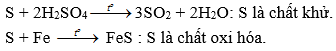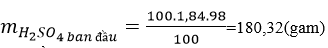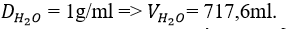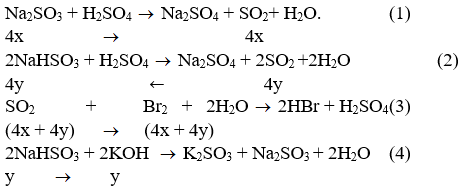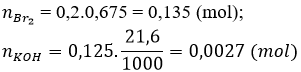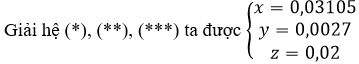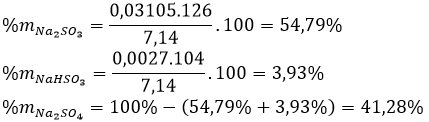Soạn Hóa học 10 nâng cao Bài 45: Hợp chất có oxi của lưu huỳnh
Với bộ tài liệu giải bài tập SGK Hóa 10 nâng cao Bài 45: Hợp chất có oxi của lưu huỳnh, hướng dẫn cách giải chi tiết cho từng câu hỏi, từng phần học bám sát nội dung chương trình sách giáo khoa bộ môn Hóa nâng cao lớp 10. Nội dung chi tiết các em xem tại đây.
Giải bài 1 trang 186 SGK Hóa lớp 10 nâng cao
Lưu huỳnh đioxit có thể tham gia những phản ứng sau: .
SO2 + Br2 + 2H2O -> 2HBr + H2SO4 (1)
SO2 + 2H2S -> 3S + 2H2O (2)
Câu nào sau đây diễn tả không đúng tính chất trong những phản ứng trên?
A. Phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (2): SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1): Br2 là chất oxi hóa, phản ứng (2): H2S là chất khử.
Lời giải:
Chọn C
Giải bài 2 trang 186 SGK Hóa lớp 10 nâng cao
Hãy ghép cặp chất và tính chất của chất sao cho phù hợp:
| A. S | a) Có tính oxi hóa |
| B. SO2 | b) có tính khử |
| C. H2S | c) chất rắn có tính oxi hóa và tính khử |
| D. H2SO4 | d) không có tính oxi hóa và tính khử |
| e) chất khí có tính oxi hóa và tính khử. |
Lời giải:
| A – c; | B – e; | C – b; | D – a; |
Giải bài 3 trang 186 SGK Hóa lớp 10 nâng cao
Hãy chọn hệ số đúng của chất oxi hóa và của chất khử trong phản ứng sau:
KMnO4 + H2O2 + H2SO4 -> MnSO4 + O2 + K2SO4 + H2O
A. 3 và 5.
B. 5 và 2
C. 2 và 5.
D. 5 và 3.
Lời giải:
Chọn C
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
Giải bài 4 trang 186 SGK Hóa lớp 10 nâng cao
Hãy lập bảng so sánh những tính chất giống nhau, khác nhau giữa hại hợp chất của lưu huỳnh là hiđro sunfua và lưu huỳnh đioxit về:
a) Tính chất vật lí.
b) Tính chất hóa học, giải thích và chứng minh bằng phương trình hóa học.
Lời giải:
a) So sánh những tính chất vật lí của H2S và SO2.
| Giống nhau | Khác nhau | |
| Hiđro sunfua | - Khí không màu - Nặng hơn không khí | - Mùi trứng thôi - Khí rất độc - Tan ít trong nước - Hóa lỏng ở -60°C |
| Lưu huỳnh đioxit | - Khí không màu - Nặng hơn không khí | - Mùi hắc - Khí độc - Tan nhiều trong nước - Hóa lỏng ở - 10oC |
b) So sánh những tính chất hóa học của H2S và SO2.
Giải bài 5 trang 186 SGK Hóa lớp 10 nâng cao
Hãy lập những phương trình hóa học sau và cho biết vai trò của các chất tham gia phản ứng.
a) SO2 + Fe2(SO4)3 + H2O → H2SO4 + FeSO4
b) SO2 + K2Cr2O7 + H2SO4 → K2SO4+ Cr2(SO4)3 + H2O
c) H2S + Cl2 → S + HCl
d) H2S + SO2 → S + H2O
c) SO2 + Br2 + H2O → HBr + H2SO4.
Lời giải:
SO2 + Fe2(SO4)3 + 2H2O → 2H2SO4 + 2FeSO4
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
H2S + Cl2 → S + 2HCl
2H2S + SO2 → 3S + 2H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Giải bài 6 trang 186 SGK Hóa lớp 10 nâng cao
Cho các dung dịch không màu của các chất sau: NaCl, K2CO3, Na2SO4, HCl, Ba(NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nào khác làm thuốc thử. Viết các phương trình hóa học, nếu có.
Lời giải:
Lấy mỗi dung dịch một ít rồi chia ra 5 ống nghiệm có đánh số. Cho lần lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
| NaCl | K2CO3 | Na2SO4 | HCl | Ba(NO3)2 | Kết luận | |
| NaCl | — | — | — | — | — | — |
| K2CO3 | — | — | — | Khí | Kết tủa | Khí, kết tủa |
| Na2SO4 | — | — | — | — | Kết tủa | Kết tủa |
| HCl | — | Khí | — | — | — | Khí |
| Ba(NO3)2 | — | Kết tủa | Kết tủa | — | — | 2 kết tủa |
Nhận xét:
Ở dung dịch nào không có hiện tượng gì thì đó là dung dịch NaCl. Ở dung dịch nào có một trường hợp thoát khí và một trường hợp kết tủa là dung dịch K2CO3.
K2CO3 + 2HCl → 2KCl + H2O + CO2 (1)
K2CO3 + Ba(NO3)2 → 2KNO3 + BaCO3 (2)
Ở dung dịch nào có một trường hợp kết tủa là dung dịch Na2SO4:
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4 (3)
Ở dung dịch nào có một trường hợp thoát khí là dung dịch HCl: Phương trình (1)
Ở dung dịch nào có hai trường hợp kết tủa là dung dịch Ba(NO3)2: Phương trình (2) và (3).
Giải bài 7 trang 186 SGK Hóa lớp 10 nâng cao
a) Axit sunfuric đặc dùng làm khô khí ẩm, hãy lấy một ví dụ. Có một số khí ẩm không được làm khô bằng axit sunfuric đặc, hãy lấy một ví dụ và cho biết vì sao.
b) Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than, được gọi là sự hóa than. Lấy ví dụ về sự hóa than của glucozơ và saccarozơ. Viết sơ đồ phản ứng.
c) Sự làm khô là sự hóa than nói trên khác nhàu như thế nào?
Lời giải:
a) Axit sunfuric đặc làm khô khí CO2 nhưng không làm khô được khí H2S vì có phản ứng: H2S + H2SO4 -> SO2 + S + 2H2O.
b) Axit sunfuric đặc có thể biến nhiều chất hữu cơ thành than:
C6H12O6 -> 6C + 6H2O (glucozơ)
C12H22O11 -> 12C+ 11H2O (saccarozơ)
c) Sự làm khô: Chất không thay đổi.
Sự hóa than: Chất biến thành chất khác trong đó có cacbon.
Giải bài 8 trang 187 SGK Hóa lớp 10 nâng cao
Có những chất, trong phản ứng hóa học này chúng là chất khử, nhưng trong phản ứng khác chúng là chất oxi hóa. Hãy viết phương trình hóa học minh họa nhận định trên cho những trường hợp sau:
a) Axit;
b) Oxit bazơ;
c) Oxit axit;
d) Muối;
e) Đơn chất
Lời giải:
a) Axit: H2SO3
H2SO3 + 2H2S -> 3S + 3H2O: H2SO3 là chất oxi hóa.
5H2SO3 + 2KMnO4 -> 2MnSO4 + K2SO4 + 2H2SO4 + 3H2O: H2SO3 là chất khử.
b) Oxit bazơ: FeO
c) Oxit axit: SO2
SO2 + 2H2S -> 3S + 2H2O: SO2 là chất oxi hóa.
SO2 + Cl2 + 2H2O -> 2HCl + H2SO4: SO2 là chất khử.
d) Muối: FeCl2.
FeCl2 + 2Cl2 -> 2FeCl3: FeCl2 là chất khử.
FeCl2 + Mg -> MgCl2 + Fe : FeCl2 là chất oxi hóa.
e) Đơn chất: S
Giải bài 9 trang 187 SGK Hóa lớp 10 nâng cao
Có 100ml H2SO4 98%, khối lượng riêng là l,84g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
a) Tính thể tích nước cần dùng để pha loãng.
b) Cách pha loãng phải tiến hành như thế nào?
Lời giải:
a) Ta có:
Gọi lượng nước cần pha là m gam
Theo đề bài, ta có: 180,32/(1,84.100 + m) = 20%
Giải ra ta được: m = 717,6 gam vì
b) Cách pha loãng phải tiến hành như thế nào?
Dùng ống đong, đong 717,6 ml nước đổ vào cốc 1 lít. Sau đó rót từ từ 100ml H2SO4 98% vào cốc đã chứa nước và khuấy đều ta thu được dung dịch H2SO4 20%
Giải bài 10 trang 187 SGK Hóa lớp 10 nâng cao
Hỗn hợp rắn X gồm có Na2SO3, NaHSO3, và Na2SO4. Cho 28,56 gam X tác dụng với dung dịch H2SO4 loãng, dư. Khí SO2 sinh ra làm mất màu hoàn toàn 675 cm3 dung dịch brom 0,2M. Mặt khác 7,14gam X tác dụng vừa đủ với 216 cm3 dung dịch KOH 0,125M.
a) Viết phương trình hóa học.
b) Tính thành phần phần trăm về khối lượng các chất trong hỗn hợp X.
Lời giải:
a) Phản ứng xảy ra:
b) Đặt số mol Na2SO3, NaHSO3, và Na2SO4 trong 7,14 gam hỗn hợp X lần lượt là x mol, y mol và z mol r ⇒ Trong 28,56 gam hỗn hợp X lần lượt là 4x mol, 4y mol và 4z mol ⇒ 126x + 104y +142z = 7,14 (∗)
Ta có:
Từ (1), (2) và (3) ⇒ 4x + 4y = 0,135 (∗∗)
Từ (4) ⇒ y = 0,0027 (∗∗∗)
Thành phần phần trăm khối lượng các chất trong hỗn hợp X:
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về giải bài tập SGK Hóa học lớp 10 nâng cao Bài 45: Hợp chất có oxi của lưu huỳnh, file PDF hoàn toàn miễn phí.
- Soạn Hóa học 10 nâng cao Bài 48: Bài thực hành số 6
- Soạn Hóa học 10 nâng cao Bài 47: Bài thực hành số 5
- Soạn Hóa học 10 nâng cao Bài 46: Luyện tập chương 6
- Soạn Hóa học 10 nâng cao Bài 45: Hợp chất có oxi của lưu huỳnh
- Soạn Hóa học 10 nâng cao Bài 44: Hiđro sunfua
- Soạn Hóa học 10 nâng cao Bài 43: Lưu huỳnh
- Soạn Hóa học 10 nâng cao Bài 42: Ozon và hiđro peoxit
- Soạn Hóa học 10 nâng cao Bài 41: Oxi chính xác nhất