Giải Bài 26 Hóa học 12: Kim loại kiềm thổ (ngắn gọn nhất)
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài tập SGK, trả lời câu hỏi SGK. Dưới đây chúng tôi đã soạn Bài 26 Hóa học 12: Kim loại kiềm thổ (ngắn gọn nhất), giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Bài 26: Kim loại kiềm thổ
Giải bài tập SGK
Bài 1 (trang 118 SGK Hóa 12):
Xếp các kim loại kiềm thổ theo chiều tăng dần điện tích hạt nhân thì:
A. bán kính nguyên tử giảm dần.
B. năng lượng ion hóa giảm dần.
C. tính khử giảm dần.
D. khả năng tác dụng với nước giảm dần.
Lời giải:
Đáp án B.
Bài 2 (trang 119 SGK Hóa 12):
Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tủa trắng và bọt khí.
D. Không có hiện tượng gì.
Lời giải:
Đáp án A.
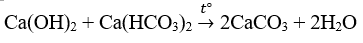
Bài 3 (trang 119 SGK Hóa 12):
Cho 2,84 g hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của hai muối( CaCO3 , MgCO3) trong hỗn hợp là :
A. 35,2 % và 64,8%.
B. 70,4% và 29,6%.
C. 85,49% và 14,51%.
D. 17,6% và 82,4%.
Lời giải:
Đáp án B.
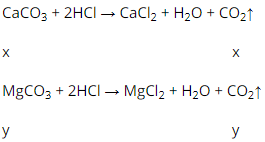
Số mol CO2: 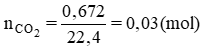
Gọi x, y lần lượt là số mol của CaCO3 và MgCO3 trong hỗn hợp
Theo bài ra ta có hệ phương trình:
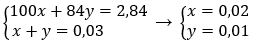
%mNa = 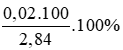 = 70,42%
= 70,42%
%mK = 100% - 70,42% = 29,58%
Bài 4 (trang 119 SGK Hóa 12):
Cho 2 kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be.
B. Mg.
C. Ca.
D. Ba.
Lời giải:
Đáp án C.
Gọi M là kim loại nhóm II, số mol là x
M + 2HCl → MCl2 + H2
x x(mol)
theo bài ra ta có hệ pt
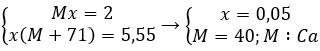
Vậy M là Ca
Bài 5 (trang 119 SGK Hóa 12):
Cho 2,8 g CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2(đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
Lời giải:
a) Số mol CaO là nCaO = 2,8/56 = 0,05 (mol)
Số mol CO2 là nCO2 = 1,68/22,4 = 0,075 (mol)
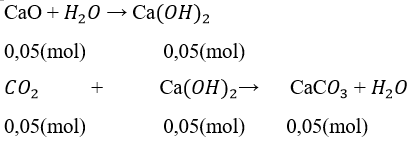
nCaCO3 = nCO2 pư = nCa(OH)2 = 0,05 mol
nCO2 dư = 0,075 – 0,05 = 0,025 (mol)
CaCO3 tạo thành 0,05 (mol) bị hòa tan 0,025 (mol)
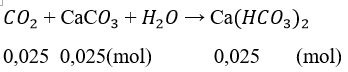
Số mol CaCO3 còn lại 0,05 – 0,025 = 0,025 (mol)
Khối lượng CaCO3 là m = 0,025. 100 = 2,5 (g)
b.Khi đun nóng dung dịch A
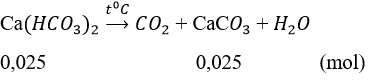
Khối lượng kết tủa tối đa thu được là m = (0,025 + 0,025).100 = 5g
Bài 6 (trang 119 SGK Hóa 12):
Bài 7 (trang 119 SGK Hóa 12):
Bài 8 (trang 119 SGK Hóa 12):
Bài 9 (trang 119 SGK Hóa 12):
........►►Còn tiếp ► Tải trọn bộ hướng dẫn giải bài tập 1 đến 9 (trang 119 SGK Hóa 12) tại đường link cuối bài:
Lý thuyết trọng tâm
1. Vị trí
- Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; trong một chu kì, kiềm thổ đứng sau kim loại kiềm.
- Kim loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti (Sr); Bari (Ba); Rađi (Ra) (Rađi là nguyên tố phóng xạ không bền).
2. Cấu tạo và tính chất
II. Tính chất vật lý
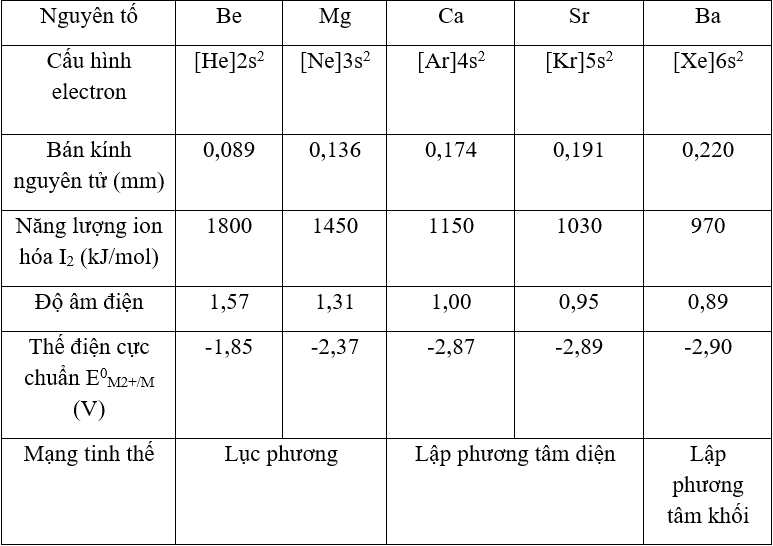
- Kim loại kiềm IIA gồm: Be: [He]2s2, Mg: [Ar]3s2, Ca: [Ar]4s2, Sr: [Kr]5s2, Ba: [Xe]6s2.
- Là những chất rắn màu trắng bạc hoặc xám nhạt, có ánh bạc, dẫn điện, dẫn nhiệt tốt.
- Nhiệt độ nóng chảy, nhiệt độ sôi tương đối thấp (cao hơn kim loại kiềm).
- Độ cứng: kim loại kiềm thổ cứng hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp; độ cứng giảm dần từ Be → Ba (Be cứng nhất có thể vạch được thủy tinh; Ba chỉ hơi cứng hơn chì).
- Khối lượng riêng tương đối nhỏ, độ cứng tuy cao hơn kim loại kiềm nhưng vẫn nhỏ hơn nhôm.
Thế điện cực chuẩn:
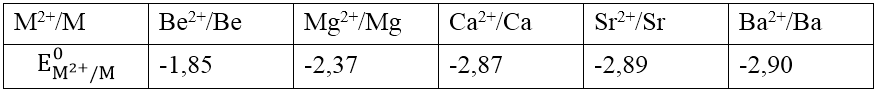
III. Tính chất hóa học
- Kim loại nhóm IIA là chất khử mạnh nhưng yếu hơn so với kim loại kiềm. Trong các hợp chất chúng có số oxi hóa +2.
- Tính khử tăng từ Be đến Ra:
M – 2e → M2+
1. Tác dụng với phi kim
- Ở to thường, Be và Mg bị oxi hóa chậm tạo thành lớp màng oxit bảo vệ, các kim loại còn lại tác dụng với mạnh hơn.
- Khi đốt nóng tất cả các kim loại nhóm IIA đều cháy thành oxit.
2M + O2 → 2MO
Ví dụ:
2Ca + O2 → 2CaO
- Với halogen: phản ứng dễ dàng ở nhiệt độ thường
M + X2 → MX2
Ví dụ:
Mg + Cl2 → MgCl2
- Với phi kim kém hoạt động phải đun nóng:
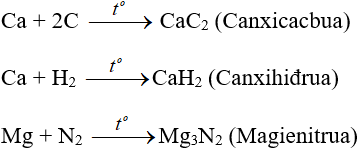
2. Tác dụng với nước H2O
- Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch bazơ:
Ca + 2H2O → Ca(OH)2 + H2↑
- Mg không tan trong nước lạnh, tan chậm trong nước nóng tạo thành MgO.
Mg + H2O → MgO + H2↑
- Be không tan trong nước dù ở nhiệt độ cao vì có lớp oxit bền bảo vệ. Nhưng Be có thể tan trong dung dịch kiềm mạnh hoặc kiềm nóng chảy tạo berilat:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
Be + 2NaOHnóng chảy → Na2BeO2 + H2
3. Tác dụng với axit
- Axit không có tính oxi hóa, khử H+ thành H2
M + 2H+ → M2+ + H2↑
Ví dụ:
Ca + 2HCl → CaCl2 + H2
- Khử N+5, S+6 thành các hợp chất mức oxi hoá thấp hơn.
4M + 10HNO3 (l) → 4M(NO3)2 + 3H2O + NH4NO3
Ví dụ:
4Ca + 10HNO3 (l) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Mg + 4HNO3 đđ → Mg(NO3)2 + 2NO2 + 2H2O
4. Ứng dụng, điều chế
a. Ứng dụng
+ Kim loại Be: làm chất phụ gia để chế tạo hợp kim có tính đàn hồi cao, bền, chắc, không bị ăn mòn.
+ Kim loại Ca: dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép, làm khô 1 số hợp chất hữu cơ.
+ Kim loại Mg có nhiều ứng dụng hơn cả: tạo hợp kim có tính cứng, nhẹ, bền để chế tạo máy bay, tên lửa, ôtô... Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm dùng trong pháo sáng, máy ảnh.
b. Điều chế
+ Điện phân nóng chảy muối halogenua
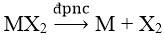
+ Ví dụ:
CaCl2 → Ca + Cl2↑
MgCl2 → Mg + Cl2↑
►►Tải free trọn bộ lời giải chi tiết từ bài 1 đến bài 9 (trang 119 SGK Hóa 12) Bài: Kim loại kiềm thổ file word, pdf tại đường link dưới đây:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô giáo tham khảo.
►Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi môn hóa học như đề kiểm tra học kì, 1 tiết, 15 phút trên lớp, hướng dẫn giải sách giáo khoa, sách bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.
- Giải Bài 26 Hóa học 12: Kim loại kiềm thổ (ngắn gọn nhất)
- Giải Hoá học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm trang 111 SGK
- Giải Hoá học 12 Bài 29: Luyện tập: Tính chất của nhôm và hợp chất của nhôm trang 134 SGK
- Giải Hoá học 12 Bài 27: Nhôm và hợp chất của nhôm trang 128, 129 SGK
- Giải Hoá học 12 Bài 30: Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng trang 135
- Giải Hoá học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất