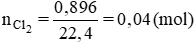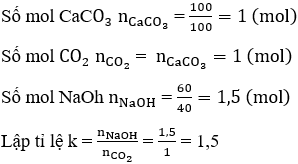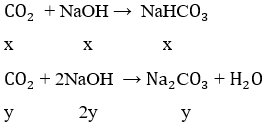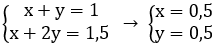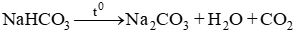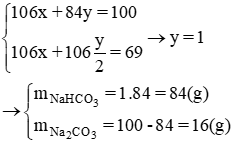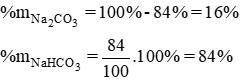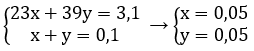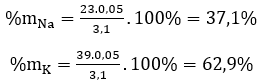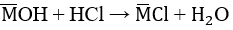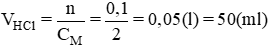Giải Hoá học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm trang 111 SGK
Sau bài học các em sẽ nắm được đặc điểm cấu tạo, tính chất vật lý, tính chất hóa học của Kim loại kiềm và hợp chất quan trọng của kim loại kiềm. Từ đó vận dụng giải các bài tập ứng dụng và chứng minh các hiện tượng trong cuộc sống hàng ngày có liên quan.
Giải Bài 1 trang 111 SGK Hóa 12
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là :
A. ns1.
B. ns2.
C. ns2np1.
D. (n-1)dsxnsy.
Lời giải:
Đáp án A.
Giải Bài 2 SGK Hóa 12 trang 111
Cation M+ có cấu hình electron ở phân lớp ngoài cùng là 2s22p6. M+ là cation nào sau đây?
A. Ag+.
B. Cu2+.
C. Na+.
D. K+.
Lời giải:
Đáp án C.
M+ có cấu hình e là: 2s22p6.
⇒ cấu hình e của M là: 2s22p63s1
⇒ M là Na ⇒ M+ là Na+
Giải Bài 3 trang 111 Hóa 12 SGK
Nồng độ phần trăm của dung dịch tạo thành khi hòa tan 39 g kali kim loại vào 362 g nước là kết quả nào sau đây?
A. 15,47%.
B. 13,87%.
C. 14%.
D. 14,04%.
Lời giải:
Đáp án C.
K + H2O → KOH + 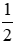
Số mol K: nK = 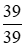
Số mol KOH: nKOH = nK = 1(mol)
Khối lượng KOH là mKOH = 56.1 = 56 (g)
Số mol H2: nH2 = 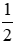
Khối lượng dung dịch là mdd = 39 + 362 – 0,5.2 = 400 (g)
Nồng độ C%KOH = 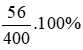
Giải Bài 4 trang 111 SGK Hóa lớp 12
Trong các muối sau, muối nào dễ bị nhiệt phân:
A. LiCl.
B. NaNO3.
C. KHCO3.
D. KBr.
Lời giải:
Đáp án C.
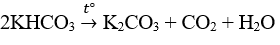
Giải Bài 5 trang 111 SGK Hóa 12
Điện phân muối clorua kim loại kiềm nóng chảy, thu được 0,896 lít khí (đktc) ở anot và 3,12 g kim loại ở catot. Hãy xác định công thức phân tử của muối kim loại kiềm.
Lời giải:
CT muối clorua của KL kiềm là MCl
2MCl -dpnc→ 2M + Cl2
Khí ở anot là Cl2. Số mol Cl2:
Số mol M là: nM = 0,04. 2 = 0,08 (mol)
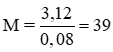
Công thức muối KCl
Giải Bài 6 trang 111 SGK Hóa học lớp 12
Cho 100g CaCO3 tác dụng hoàn toàn với dung dịch HCl để lấy khí CO2 sục vào dung dịch chứa 60 g NaOH. Tính khối lượng muối natri thu được.
Lời giải:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
K = 1,5 → phản ứng tạo hai muối NaHCO3 và Na2CO3
Gọi x, y lần lượt là số mol NaHCO3 và Na2CO3
Theo bài ra ta có hệ
Khối lượng NaHCO3 m = 84.0,5 = 42 (g)
Khối lượng Na2CO3 m = 106.0,5 = 53 (g)
Tổng khối lượng muối thu được sau phản ứng là: 42 + 53 = 95 (g)
Giải Bài 7 trang 111 SGK Hóa lớp 12
Nung 100g hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng của hỗn hợp không đổi, được 69 g chất rắn. Xác định thành phần % khối lượng của mỗi chất trong hỗn hợp ban đầu.
Lời giải:
Gọi y, x lần lượt là số mol NaHCO3 và Na2CO3
Theo bài ra ta có hệ
Thành phần % theo khối lượng các chất
Giải Bài 8 trang 111 SGK Hóa 12
Cho 3,1 g hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 ở đktc và dung dịch kiềm.
a) Xác định tên 2 KL đó và tính thành phần phần trăm khối lượng mỗi kim loại
b) Tính thể tích dd HCl 2M cần dùng để trung hòa dd kiềm và khối lượng muối clorua thu được.
Lời giải:
a. Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 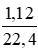
PTHH: 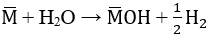
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 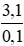
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
b.
Theo pt: nHCl = nMOH = 0,1 (mol)
m(MCl) = 0,1.(31 + 35,5) = 6,65(g)
Lý thuyết Hóa 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Ví trí, cấu tạo
1. Vị trí của kim loại kiềm trong bảng tuần hoàn
- Các kim loại kiềm gồm Li, Na, K, Rb, Cs, Fr.
- Các kim loại kiềm đứng đầu mỗi chu kì (trừ chu kì 1).
2. Cấu tạo
- Cấu hình electron nguyên tử: ns1.
- Các kim loại kiềm có năng lượng ion hóa I1 nhỏ nhất so với các kim loại khác. Từ Li đến Fr, I1 giảm dần.
- Cấu tạo đơn chất: các đơn chất nhóm IA đều có cấu tạo mạng lập phương tâm khối.
Tính chất vật lý
- Liên kết kim loại yếu
- Là những kim loại rất nhẹ và mềm, dẫn điện và dẫn nhiệt tốt.
- Nhiệt độ nóng chảy và nhiệt độ sôi thấp, giảm từ Li đến Fr.
- Độ cứng nhỏ
Tính chất hóa học
- Các kim loại kiềm có tính khử mạnh: M → M+ + 1e.
- Trong mọi hợp chất, kim loại kiềm có số oxi hóa +1.
1. Tác dụng với phi kim: O2, halogen, S,...
Chú ý:
- Tác dụng với oxi khô tạo peoxit: 2Na + O2 → Na2O2 (r)
- Tác dụng với oxi không khí khô ở nhiệt độ phòng tạo Na2O.
2. Tác dụng với axit: 2M + 2H+ → 2M+ + H2
Na + HCl → NaCl + 1/2 H2↑
Na dư + H2O → NaOH + 1/2 H2↑
3. Tác dụng với nước: 2M + 2H2O → 2MOH(dd) + H2
Na + H2O → NaOH + 1/2 H2
4. Tác dụng với dd muối
Khi cho Na tác dụng với dd muối CuSO4 sẽ có bọt khí và kết tủa Cu(OH)2 màu xanh.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Chú ý: Khi cho kim loại kiềm vào dung dịch muối, đầu tiên kim loại kiềm sẽ tác dụng với nước sau đó bazo sinh ra có thể tác dụng với muối.
Ứng dụng, điều chế
1. Ứng dụng:
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy.
- K, Na dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
- Cs dùng chế tạo tế bào quang điện.
- Dùng để điều chế một số kim loại quí hiếm bằng phương pháp nhiệt luyện.
- Dùng làm xúc tác trong nhiều phản ứng hữu cơ.
2. Điều chế:
Điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
Ví dụ:
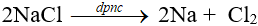
►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hóa 12 bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm SGK trang 111 file PDF hoàn toàn miễn phí!
- Giải Bài 26 Hóa học 12: Kim loại kiềm thổ (ngắn gọn nhất)
- Giải Hoá học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm trang 111 SGK
- Giải Hoá học 12 Bài 29: Luyện tập: Tính chất của nhôm và hợp chất của nhôm trang 134 SGK
- Giải Hoá học 12 Bài 27: Nhôm và hợp chất của nhôm trang 128, 129 SGK
- Giải Hoá học 12 Bài 30: Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng trang 135
- Giải Hoá học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất