Giải Hoá học 12 bài 31: Sắt trang 141 SGK
Sau bài học các em sẽ nắm được đặc điểm cấu tạo, tính chất vật lý, tính chất hóa học của Sắt. Từ đó vận dụng giải các bài tập ứng dụng và chứng minh các hiện tượng trong cuộc sống hàng ngày có liên quan.
Giải bài tập SGK Hóa 12 Bài 31
Giải bài 1 trang 141 SGK Hoá 12
Các kim loại nào sau đây đều phản ứng với dung dịch CuCl2?
A. Na, Mg, Ag.
B. Fe, Na, Mg.
C. Ba, Mg, Hg.
D. Na, Ba, Ag.
Lời giải:
Đáp án B.
Các phản ứng xảy ra:
Fe + CuCl2 → FeCl2 + Cu
2Na + 2H2O → 2NaOH + H2
2NaOH + CuCl2 → 2NaCl + Cu(OH)2
Mg + CuCl2 → MgCl2 + Cu
Giải bài 2 Hoá 12 SGK trang 141
Cấu hình electron nào sau đây là của Fe3+ ?
A. [Ar]3d6.
B. [Ar]3d5.
C. [Ar]3d4.
D. [Ar]3d3.
Lời giải:
Đáp án B.
Cấu hình e của Fe: [Ar]3d64s2
⇒ cấu hình e của Fe3+: [Ar]3d5
Giải bài 3 SGK Hoá 12 trang 141
Cho 3,52 gam một kim loại tác dụng hết với dung dịch H2SO4 loãng, thu được 6,84 gam muối sunfat. Kim loại đó là
A. Mg.
B. Zn.
C. Fe.
D. Al.
Lời giải:
Đáp án C.
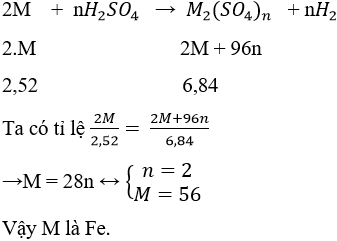
Giải bài 4 trang 141 SGK Hoá 12
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68 %. Kim loại đó là :
A. Zn.
B. Fe.
C. Al.
D. Ni.
Lời giải:
Đáp án B.
Khối lượng kim loại phản ứng là 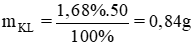
Số mol H2 là 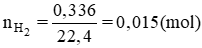
2M + 2n HCl → 2MCl2 + nH2
Số mol của M là:
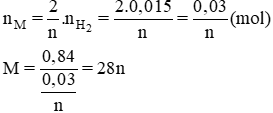
→ {n = 2, M = 56} → M: Fe
Giải bài 5 Hoá 12 SGK trang 141
Hỗn hợp A chứa Fe và kim loại M có hóa trị không đổi trong mọi hợp chất. Tỉ lệ số mol của M và Fe trong hỗn hợp là 1 : 3. Cho 19,2 gam hỗn hợp A tan hết vào dung dịch HCl thu được 8,96 lít khí H2 Cho 19,2 gam hỗn hợp A tác dụng hết với Cl2 thì cần dùng 13,32 lít khí Cl2. Xác định kim loại M và phần trăm khối lượng các kim loại trong hỗn hợp A. Các thể tích khí đo ở đktc.
Lời giải:
Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 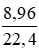 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 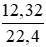 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
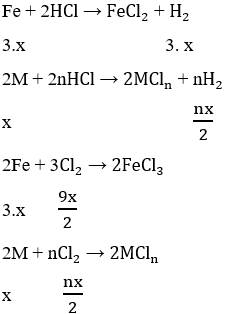
Theo bài ra ta có hệ phương trình:
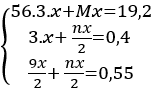
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
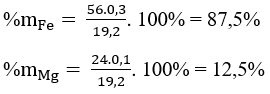
Lý thuyết Hóa 12 Bài 31: Sắt
I. Vị trí, cấu tạo
- Fe thuộc ô 26, chu kì 4, nhóm VIIIB
- Cấu hình e: 1s22s22p63s23p63d64s2 ⇒ Fe là nguyên tố d, có 2e ngoài cùng, 8e hoá trị II.
II. Tính chất vật lý
- Fe là kim loại nặng, dễ rèn, màu trắng hơi xám.
- Có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ (khác với các kim loại khác).
- Fe có cấu tạo mạng tinh thể lập phương tâm diện hoặc tâm khối tuỳ vào nhiệt độ.
III. Tính chất hóa học
1. Tác dụng với phi kim:
- Tác dụng với lưu huỳnh:
- Tác dụng với oxi:
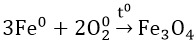
- Tác dụng với Cl2:
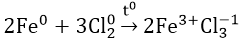
2. Tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2↑
- Với dung dịch HNO3 và H2SO4 đặc, nóng:
Fe + 4HNO4 loãng → Fe(NO3)3 + NO + 2H2O
- Chú ý: Fe bị thụ động với các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
3. Tác dụng với dung dịch muối
Fe + CuSO4 → FeSO4 + Cu↓
4. Tác dụng với nước ở nhiệt độ cao
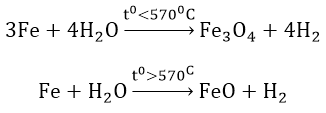
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hóa 12 bài 31: Sắt SGK trang 141 file PDF hoàn toàn miễn phí!
- Giải Hoá học 12 bài 33: Hợp kim của sắt trang 151 SGK
- Giải Hoá học 12 bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt trang 165 SGK
- Giải Hoá học 12 bài 36: Sơ lược về niken, kẽm, chì, thiếc trang 163 SGK
- Giải Hoá học 12 bài 34: Crom và hợp chất của crom trang 155 SGK
- Giải Hoá học 12 bài 32: Hợp chất của sắt trang 145 SGK
- Giải Hoá học 12 Bài 39: Thực hành SGK trang 168 đầy đủ nhất
- Giải Hoá học 12 Bài 38: Luyện tập SGK trang 166, 167 đầy đủ nhất
- Giải Hoá học 12 bài 35: Đồng và hợp chất của đồng trang 158, 159 SGK