Soạn Hóa học Lớp 10 Bài 16: Luyện tập - Liên kết hóa học trang 76
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài toán, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn giải Hóa học Lớp 10 Bài 16: Luyện tập - Liên kết hóa học trang 76 đầy đủ nhất, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Bài 16: Luyện tập - Liên kết hóa học trang 76
Bài tập:
Bài 1 (trang 76 SGK Hóa 10):
a) Viết phương tình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na → Na+ ; Cl → Cl-
Mg → Mg2+; S → S2-
Al → Al3+; O → O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
Hướng dẫn giải chi tiết:
a) Na → Na+ + 1e; Cl + 1e → Cl-
Mg → Mg2+ + 2e; S + 2e → S2-
Al → Al3+ + 3e; O +2e → O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na : 1s22s22p63s1; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl : 1s22s22p63s23p5; Cl-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O : 1s22s22p4; O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
Bài 2 (trang 76 SGK Hóa 10):
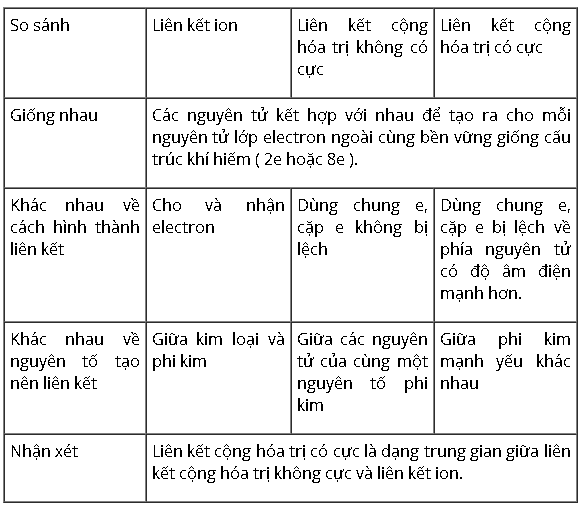
Trình bày sự giống nhau và khác nhau của 3 loại liên kết : Liên kết ion, liên kết cộng hóa trị không có cực và liên kết cộng hóa trị có cực.
Bài 3 (trang 76 SGK Hóa 10):
Cho dãy oxit sau đây: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Dựa vào giá trị hiệu độ âm điện của 2 nguyên tử trong phân tử hãy xác định loại liên kết trong từng phân tử oxit (tra giá trị độ âm điện ở bảng 6, trang 45).
Hướng dẫn giải chi tiết:
Hiệu độ âm điện của các chất:
Na2O: 2,51 liên kết ion.
MgO: 2,13 liên kết ion.
Al2O3: 1,83 liên kết ion.
SiO2: 1,54 liên kết cộng hóa trị có cực
P2O5: 1,25 liên kết cộng hóa trị có cực
SO3: 0,86 liên kết cộng hóa trị có cực
Cl2O7: 0,28 liên kết cộng hóa trị không cực
Bài 4 (trang 76 SGK Hóa 10):
a) Dựa vào giá trị độ âm điện (F: 3,98; O: 3,44; Cl: 3,16; N: 3,04) hãy xét xem tính phi kim thay đổi như thế nào của dãy nguyên tố sau : F, O, N, Cl.
b) Viết công thức cấu tạo của các phân tử sau đây: N2, CH4, H2O, NH3.
Xét xem phân tử nào có liên kết không phân cực, liên kết phân cực mạnh nhất.
Hướng dẫn giải chi tiết:
a)
F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: độ âm điện giảm dần, tính phi kim giảm dần ( vì độ âm điện đặc trưng cho khả năng hút em electron về phía nguyên tử đó)
b)
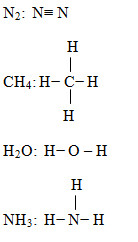
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Nhận xét: Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực.
Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.
→Còn tiếp:........................
►Tải trọn bộ hướng dẫn giải Hóa học Lớp 10 Bài 16: Luyện tập - Liên kết hóa học trang 76 tại đường link cuối bài.
Lý thuyết Liên kết hóa học:
1. Liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững.
2. Liên kết ion
- Anion: Ion mang điện tích âm.
Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
- Cation: Ion mang điện tích dương
Nếu các nguyên tử nhường electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
- Liên kết ion: là liên kết tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
3. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Liên kết cộng hóa trị được chia thành 2 loại:
+ Liên kết cộng hóa trị có cực: Khi cặp liên electron dùng chung phân bố đối xứng giữa hai hạt nhân nguyên tử than gia liên kết thì đó là liên kết hóa trị không phân cực.
+ Liên kết cộng hóa trị không cực: Khi cặp electron dùng chung bị hút lệch về nguyền tử có độ âm điện lớn hơn thì đó là liên kết cộng hóa trị có cực.
4. Sự lai hóa
- Sự lai hóa obitan nguyên tử là sự tổ hợp "trộn lẫn" một số obitan trong một nguyên tử để được từng ấy obitan lai hóa giống nhau nhưng định hướng khác nhau trong không gian.
- Các kiểu lai hóa thường gặp:
+ Lai hóa sp: Là sự tổ hợp 1 obitan s với 1 obitan p tạo thành 2 obitan lai hóa sp. Góc liên kết bằng 180o.
+ Lai hóa sp2: Là sự tổ hợp 1 obitan s với 2 obitan p tạo thành 3 obitan lai hóa sp2. Góc liên kết bằng 120o.
+ Lai hóa sp3: Là sự tổ hợp 1 obitan s với 3 obitan p tạo thành 4 obitan lại hóa sp3. Các trục đối xứng của chúng tạo với nhau 1 góc 109o28’.
File tải miễn phí hướng dẫn soạn Bài 16: Luyện tập - Liên kết hóa học:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô tham khảo và đối chiếu đáp án chính xác.
Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi môn toán như đề kiểm tra, hướng dẫn giải sách giáo khoa, vở bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.
- Giải bài tập Hóa 10 Bài 12: Liên kết ion. Tinh thể ion SGK trang 59, 60
- Giải bài tập Hóa 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Giải bài tập Hóa 10 Bài 13: Liên kết cộng hóa trị SGK trang 64
- Giải Hoá học 10 Bài 16: Luyện tập: Liên kết hóa học trang 76 SGK
- Giải Hoá học 10 Bài 15: Hóa trị và số oxi hóa trang 74 SGK
- Soạn Hóa học Lớp 10 Bài 16: Luyện tập - Liên kết hóa học trang 76