Giải bài tập Hóa 10 Bài 12: Liên kết ion. Tinh thể ion SGK trang 59, 60
Sau bài học các em sẽ nắm được sự hình thành của liên kết anion, ion, cation. Từ đó vận dụng kiến thức đã học giải các bài tập ứng dụng và chứng minh các hiện tượng trong cuộc sống hàng ngày có liên quan.
Giải bài tập SGK Hóa 10 Bài 12
Bài 1 (trang 59 SGK Hóa 10):
Liên kết hóa học trong NaCl được hình thành là do.
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Mỗi nguyên tử Na và Cl góp chung 1 electron.
C. Mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất
Lời giải:
D đúng
Bài 2 (trang 59 SGK Hóa 10):
Muối ăn ở thể rắn là
A. Các phân tử NaCl
B. Các ion Na+ và Cl-
C. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Lời giải:
C đúng.
Bài 3 (trang 60 SGK Hóa 10):
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-).
b) Những điện tích ở ion Li+ và O2- do đâu mà có?
c) Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm nào có cấu hình electron giống O2-.
d) Vì sao 1 nguyên tử oxi kết hợp được với 2 nguyên tử liti?
Lời giải:
a) Cấu hình electron của cation liti (Li+) là 1s2 và anion oxit (O2-) là 1s22s22p6.
b) Điện tích ở Li+ do mất 1e mà có, điện tích ở O2- do O nhận thêm 2e mà có.
c) Nguyên tử khí hiếm He có cấu hình electron giống Li+
Nguyên tử khí hiếm Ne có cấu hình electron giống O2-
d) Vì mỗi nguyên tử liti chỉ có thể nhường 1e, mà một nguyên tử oxi thu 2e.
2Li → 2Li+ + 2e;
O + 2e → O2-;
2Li+ + O2- → Li2O.
Bài 4 (trang 60 SGK Hóa 10):
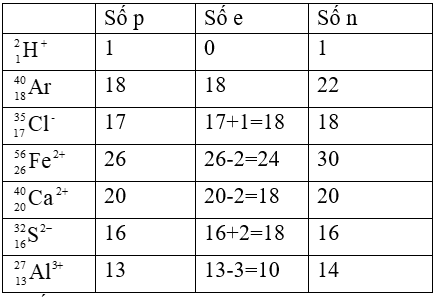
Xác định số proton, notron, electron trong các nguyên tử và ion sau:
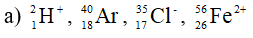
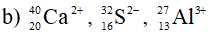
Lời giải:
Số proton, notron, electron trong các nguyên tử và ion sau:
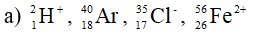
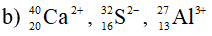
Bài 5 (trang 60 SGK Hóa 10):
So sánh số electron trong các cation sau: Na+, Mg2+, Al3+
Lời giải:
Các ion Na+, Mg2+, Al3+ đều có 10 electron.
Vì ZNa = 11 ⇒ Na có 11e ⇒ Na+ có 11 - 1 = 10e
ZMg = 12 ⇒ Mg có 12e ⇒ Mg2+ có 12 - 2 = 10e
ZAl = 13 ⇒ Al có 13e ⇒ Al3+ có 13 - 3 = 10e
Bài 6 (trang 60 SGK Hóa 10):
Trong các hợp chất sau đây, chất nào chứa ion đa nguyên tử, kể tên các ion đa nguyên tử đó:
a) H3PO4.
b) NH4NO3.
c) KCl.
d) K2SO4.
e) NH4Cl.
f) Ca(OH)2.
Lời giải:
| H3PO4 | NH4NO3 | K2SO4 | NH4Cl | Ca(OH)2 | |
| Ion đa nguyên tử | Ion PO43- | NH4+ và NO3- | SO42- | NH4+ | OH- |
| Tên gọi | Anion photphat | Cation amoni NH4+ và Anion nitrat NO3- | Anion sunphat | Cation amoni | Anion hidroxit |
Lý thuyết Hóa 10 Bài 12: Liên kết ion. Tinh thể ion
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
I. Sự tạo thành liên kết ion, anion, cation
1/ Sự tạo thành ion:
- Trong phản ứng hóa học, khi nguyên tử, phân tử thêm hoặc mất bớt electron nó sẽ tạo thành các phần tử mang điện được gọi là ion. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa liên kết ion.
- Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
- Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
Ví dụ: Các phân tử NaCl, MgCl2,BaF2,…đều chứa liên kết ion, là liên kết được hình thành giữa các cation kim loại và anion phi kim.
+ Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
Ví dụ: Các phân tử NH4Cl, MgSO4, AgNO3,… đều chứa liên kết ion, là liên kết được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
Đặc điểm của hợp chất ion: Các hợp chấy ion có nhiệt độ nóng chảy và nhiệt độ sôi cao, dẫn điện khi tan tròn nước hoặc nóng chảy.
- Ion được chia thành cation và anion:
Cation : Ion dương
Anion : Ion âm
2/ Sự tạo thành cation
- Ion mang điện tích dương gọi là ion dương hay cation.
- Nếu các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ : Sự hình thành Cation của nguyên tử Li(Z=3)
Cấu hình e: 1s22s1
1s22s1 → 1s2 + 1e
(Li) (Li+)
Hay: Li → Li+) + 1e
Li+) gọi là cation liti
3) Sự tạo thành anion
- Ion mang điện tích âm gọi là ion âm hay anion.
- Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
Ví dụ : Sự hình thành anion của nguyên tử F(Z=9)
Cấu hình e: 1s22s22p5
1s22s22p5 + 1 e → 1s22s22p6
(F) (F –)
Hay: F + 1e → F–)
F -gọi là anion florua
4/ Ion đơn nguyên tử và ion âm đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử . Thí dụ cation Li+) , Na+, Mg2+, Al3+và anion F -, Cl-, S2- , …….
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm . Thí dụ : cation amoni NH4+, anion hidroxit OH-, anion sunfat SO42–, …….
II. Sự tạo thành liên kết ion
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Na+ + Cl- → NaCl
Liên kết giữa cation Na+ và anion Cl- là liên kết ion.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải bài tập Hóa 10 Bài 12: Liên kết ion. Tinh thể ion SGK trang 59, 60 file Word, pdf hoàn toàn miễn phí!
- Giải bài tập Hóa 10 Bài 12: Liên kết ion. Tinh thể ion SGK trang 59, 60
- Giải bài tập Hóa 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Giải bài tập Hóa 10 Bài 13: Liên kết cộng hóa trị SGK trang 64
- Giải Hoá học 10 Bài 16: Luyện tập: Liên kết hóa học trang 76 SGK
- Giải Hoá học 10 Bài 15: Hóa trị và số oxi hóa trang 74 SGK
- Soạn Hóa học Lớp 10 Bài 16: Luyện tập - Liên kết hóa học trang 76