Giải bài tập Hóa 10 Bài 13: Liên kết cộng hóa trị SGK trang 64
Sau bài học các em sẽ nắm được sự hình thành liên kết cộng hóa trị và các tính chất của chất có liên kết cộng hóa trị. Từ đó vận dụng giải các bài tập ứng dụng và chứng minh các hiện tượng trong cuộc sống hàng ngày có liên quan.
Giải bài tập SGK Hóa 10 Bài 13:
Bài 1 (trang 64 SGK Hóa 10):
Liên kết cộng hóa trị là liên kết
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
Lời giải:
D đúng.
Bài 2 (trang 64 SGK Hóa 10):
Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
Lời giải:
B đúng.
Bài 3 (trang 64 SGK Hóa 10):
Độ âm điện của một nguyên tử đặc trưng cho
A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Chọn đáp án đúng.
Lời giải:
A đúng.
Bài 4 (trang 64 SGK Hóa 10):
Thế nào là liên kết ion, liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực, liên kết cộng hóa trị có cực. Cho thí dụ minh họa.
Lời giải:
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Thí dụ : K+ + Cl- → KCl.
Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung.
Thí dụ:
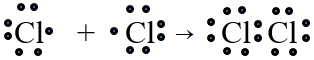
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực
Thí dụ:
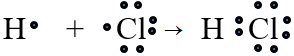
hay H – Cl
Bài 5 (trang 64 SGK Hóa 10):
Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đậy: AlCl3, CaCl2, CaS, Al2S3?
Lấy giá trị độ âm điện của các nguyên tố ở bảng 6 trang 45.
Lời giải:
Hiệu độ âm điện:
CaCl2: 2,16. Liên kết ion
AlCl3: 1,55. Liên kết cộng hóa trị có cực
CaS: 1,58.Liên kết cộng hóa trị có cực.
Al2S3: 0,97. Liên kết cộng hóa trị có cực.
Bài 6 (trang 64 SGK Hóa 10):
Viết công thức electron và công thức cấu tạo các phân tử sau: Cl2, CH4, C2H2, C2H4, NH3.
Lời giải:
Công thức electron và công thức cấu tạo các phân tử sau:
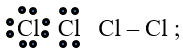
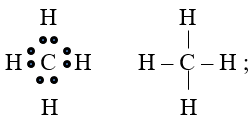
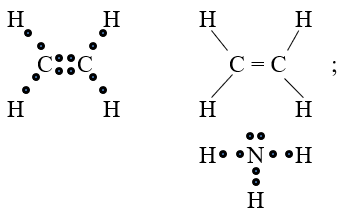
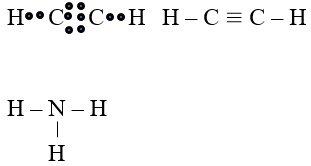
Bài 7 (trang 64 SGK Hóa 10):
X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Lời giải:
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
Lý thuyết Hóa 10 Bài 13
I. Sự hình thành liên kết cộng hóa trị bằng cặp electron chung
1. Sự hình thành phân tử đơn chất
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
- Các phân tử đơn chất tạo nên từ các nguyên tử của cùng một nguyên tố (có độ âm điện như nhau), nên các cặp electron chung không bị hút lệch về phía nguyên tử nào. Do đó, liên kết trong các phân tử đó không bị phân cực. Đó là liên kết cộng hóa trị không cực.
2. Sự hình thành phân tử hợp chất
- Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
- Với những phân tử có cấu tạo thẳng như CO2: Liên kết giữa hai nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, kết quả là toàn bộ phân tử không bị phân cực.
- Liên kết cho - nhận
+ Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho - nhận.
+ Điều kiện để có liên kết cho – nhận:
* Có nguyên tử còn dư một cặp electron chưa sử dụng.
* Có nguyên tử còn thiếu một cặp electron.
Ví dụ: Đối với phân tử SO2 công thức electron, công thức cấu tạo có thể biểu diễn như sau:

3. Tính chất của các chất có liên kết cộng hóa trị
- Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot, ... có thể là chất lỏng: nước, ancol,... hoặc chất khí như khí cacbonic, clo, hiđro, ...
- Các chất có cực như ancol etylic, đường, ... tan nhiều trong dung môi có cực như nước.
- Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua, ...
- Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
II. Liên kết cộng hóa trị và sự xen phủ các obitan nguyên tử
1. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử đơn chất
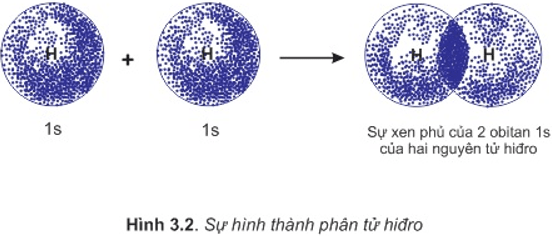
a. Sự hình thành phân tử H2
- Để hình thành liên kết giữa hai nguyên tử H trong phân tử hiđro, hai obitan 1s của hai nguyên tử H xen phủ với nhau tạo ra vùng xen phủ giữa hai hạt nhân nguyên tử.
- Ngoài lực đẩy tương hỗ giữa hai proton và hai electron còn có lực hút giữa các electron vơi hai hạt nhân hướng về tâm phân tử.
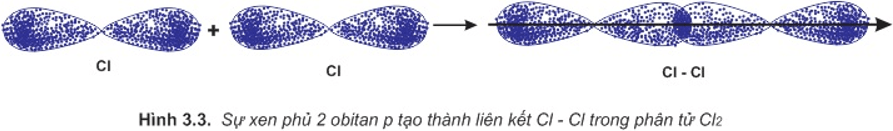
b. Sự hình thành phân tử Cl2
Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
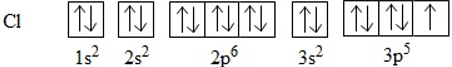
Sự hình thành liên kết giữa hai nguyên tử clo là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử clo:
2. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử hợp chất
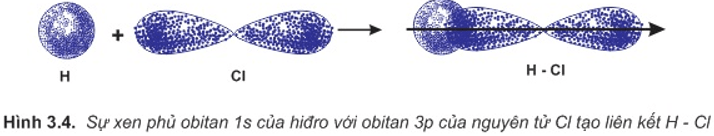
a. Sự hình thành phân tử HCl
Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xenphủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo.
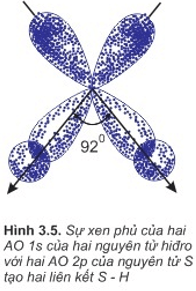
b. Sự hình thành phân tử H2S
- Là sự xen phủ giữa obitan 1s của các nguyên tử hiđro và 2 obitan p của nguyên tử lưu huỳnh.
- 2 obitan p có 2 electron độc thân của nguyên tử S xen phủ với 2 obitan 1s có của 2 nguyên tử H tạo nên liên kết S−H.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải bài tập Hóa 10 Bài 13: Liên kết cộng hóa trị SGK trang 64 file Word, pdf hoàn toàn miễn phí!
- Giải bài tập Hóa 10 Bài 12: Liên kết ion. Tinh thể ion SGK trang 59, 60
- Giải bài tập Hóa 10 Bài 14: Tinh thể nguyên tử và tinh thể phân tử
- Giải bài tập Hóa 10 Bài 13: Liên kết cộng hóa trị SGK trang 64
- Giải Hoá học 10 Bài 16: Luyện tập: Liên kết hóa học trang 76 SGK
- Giải Hoá học 10 Bài 15: Hóa trị và số oxi hóa trang 74 SGK
- Soạn Hóa học Lớp 10 Bài 16: Luyện tập - Liên kết hóa học trang 76