Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
Mời thầy cô và các bạn học sinh tham khảo ngay Giải SBT Hóa 9 Bài 18: Nhôm (ngắn gọn) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ nhất dưới đây.
Giải Hóa học 9 Bài 18 SBT: Nhôm
Bài 18.1 trang 22 Sách bài tập Hóa học 9
Kim loại Al không phản ứng với dung dịch
A. NaOH loãng ;
C. HNO3 đặc, nóng ;
B. H2SO4 đặc,nguội ;
D. H2SO4 loãng.
Lời giải:
Đáp án B.
Bài 18.2 trang 22 Sách bài tập Hóa học 9
Kim loại Al tác dụng được với dung dịch
A. Mg(NO3)2 ;
B. Ca(NO3)2 ;
C. KNO3 ;
D. Cu(NO3)2
Lời giải:
Đáp án D.
Bài 18.3 trang 22 Sách bài tập Hóa học 9
Một kim loại có đủ các tính chất sau :
a) Nhẹ, dẫn điện và dẫn nhiệt tốt.
b) Phản ứng mạnh với dung dịch axit clohiđric.
c) Tan trong dung dịch kiềm giải phóng khí hiđro.
Kim loại đó là
A. sắt;
B. đồng ;
C. kẽm ;
D. nhôm.
Lời giải:
Đáp án D.
Nhôm là kim loại có đủ các tính chất : nhẹ, dẫn điện, dẫn nhiệt, phản ứng mạnh với dung dịch axit clohiđric và tan trong dung dịch kiềm giải phóni: khí hiđro.
Bài 18.4 trang 22 Sách bài tập Hóa học 9
Nhằm xác định vị trí của những kim loại X, Y, Z, T trong dãy hoạt động hoá học, người ta thực hiện phản ứng của kim loại với dung dịch muối của kim loại khác, thu được những kết quả sau :
Thí nghiệm 1 : Kim loại X đẩy kim loại z ra khỏi muối.
Thí nghiệm 2 : Kim loại Y đẩy kim loại z ra khỏi muối.
Thí nghiệm 3 : Kim loại X đẩy kim loại Y ra khỏi muối.
Thí nghiệm 4 : Kim loại z đẩy kim loại T ra khỏi muối.
Em hãy sắp xếp các kim loại theo chiều mức độ hoạt động hoá học giảm dần.
Lời giải:
Mức độ hoạt động hoá học của các kim loại theo chiều giảm dần :
X > Y > Z > T
Bài 18.5 trang 23 Sách bài tập Hóa học 9
Viết các phương trình hóa học thực hiện những chuyển đổi hóa học sau:
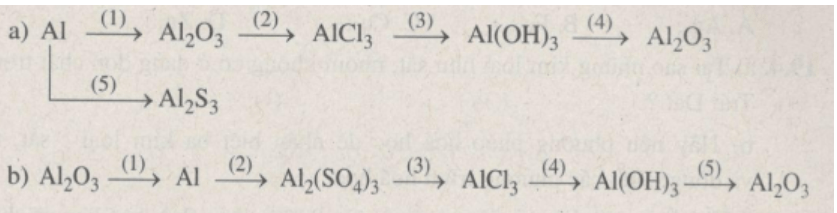
Lời giải:
a)
(1) 4Al + 3O2 to→ 2Al2O3
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
(4) 2Al(OH)3 to→ Al2O3 + 3H2O
(5) 2Al + 3S to→ Al2S3
b)
(1) 2Al2O3 to→ 4Al + 3O2
(2) 2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2
(3) Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4
(4) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
(5) 2Al(OH)3 to→ Al2O3 + 3H2O
Bài 18.6 trang 23 Sách bài tập Hóa học 9
Nhúng một lá nhôm vào dung dịch CuSO4. Sau một thời gian, lấy lá nhôm ra khỏi dung dịch thì thấy khối lượng dung dịch giảm 1,38 gám. Khối lượng của Al đã tham gia phản ứng là
A. 0,27 gam ; B. 0,81 gam ; C. 0,54 gam ; D. 1,08 gam.
Lời giải:
Đáp án C.
Gọi khối lượng miếng Al là a gam, lượng nhôm đã phản ứng là x gam :
2Al + 3CuSO4 → Al2(SO4)3 + 3 Cu
Gọi x là khối lượng Al phản ứng.
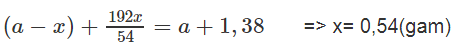
So với khối lượng miếng Al ban đầu thì khối lượng miếng Al sau phản ứng tăng 1,38 gam. Ta có phương trình :
Bài 18.7 trang 23 Sách bài tập Hóa học 9
Hoà tan 4,5 gam hợp kim nhôm - magie trong dung dịch H2SO4 loãng, dư, thấy có 5,04 lít khí hiđro bay ra (đktc).
a) Viết phương trình hoá học.
b) Tính thành phần phần trăm khối lượng của các kim loại trong hợp kim
Lời giải:
nH2 = 5,04/22,4 = 0,225 mol
Mg + H2SO4 → MgSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Gọi nMg = x; nAl = y
Ta có hệ phương trình
24x + 27y = 4,5
x + 3y/2 = 0,225
Giải phương trình (I) và (II), ta tìm được x và y.
x = 0,075; y = 0,1
mMg = 1,8g; mAl = 2,7g
%mMg = 40%; %mAl = 60%
Bài 18.8 trang 23 Sách bài tập Hóa học 9
Trong một loại quặng boxit có 50% nhôm oxit. Nhôm luyện từ oxit đó còn chứa 1,5% tạp chất. Tính lượng nhôm thu được khi luyện 0,5 tấn quặng boxit trên. Hiệu suất phản ứng 100%.
Lời giải:
Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2Al2O3 → 4Al + 3O2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).
Bài 18.9 trang 23 Sách bài tập Hóa học 9
Cho 5,4 gam Al vào 100 ml dung dịch H2SO4 0,5M.
a) Tính thể tích khí H2 sinh ra (đktc).
b) Tính nồng độ mol của các chất trong dung dịch sau phản ứng. Cho ràng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Lời giải:
a) nAl = 5,4/27 = 0,2 mol; nH2SO4 = 0,1 x 0,5 = 0,05 mol
Phương trình hóa học
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Có 0,2/2 > 0,05/3
→ Dư Al nên tính lượng các chất theo lượng H2SO4
nH2 = 0,05/3 x 3 = 0,05 mol
VH2 = 0,05 x 22,4 = 1,12l
nAl2(SO4)3 = 0,05/3 x 1 ≈ 0,017 mol
CM(Al2(SO4)3) = 0,017/0,1 = 0,17M
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
- Giải SBT Hóa học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng (chính xác nhất)
- Giải SBT Hóa học 9 Bài 25: Tính chất của phi kim (chính xác nhất)
- Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
- Giải SBT Hóa học 9 Bài 55: Thực hành: Tính chất của gluxit (chính xác nhất)
- Giải SBT Hóa học 9 Bài 54: Polime (chính xác nhất)
- Giải SBT Hóa học 9 Bài 53: Protein (chính xác nhất)
- Giải SBT Hóa học 9 Bài 52: Tinh bột và xenlulozơ (chính xác nhất)