Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
Mời thầy cô và các bạn học sinh tham khảo ngay Giải SBT Hóa 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (ngắn gọn) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ nhất dưới đây.
Giải Hóa học 9 Bài 56 SBT: Ôn tập cuối năm: Phần 1: Hóa vô cơ
I. Kiến thức cần nhớ
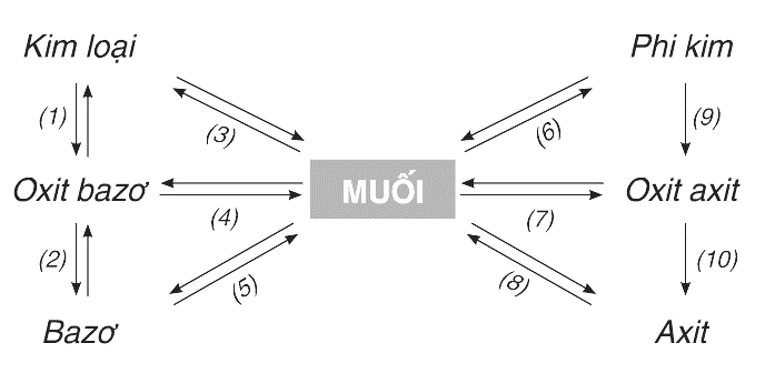
1. Mối quan hệ giữa các loại chất vô cơ thể hiện trong sơ đồ sau:
Các phương trình hóa học thể hiện mối quan hệ giữa các loại chất vô cơ
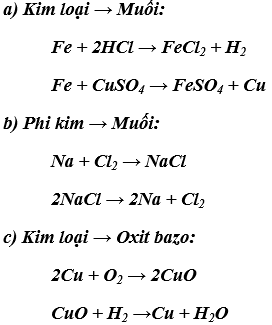
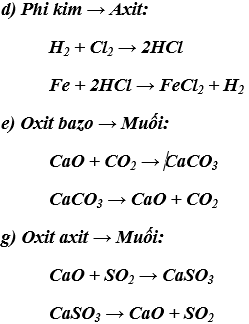
Xem thêm các bài Giải bài tập Vở bài tập Hóa học 9 hay khác:
Bài 1. (Trang 139 VBT Hóa học 9 )
Hãy nhận biết từng cặp chất sau đậy bằng phương pháp hóa học.
a) Dung dịch H2SO4và dung dịch CuSO4
b) Dung dịch HCl và dung dịch FeCl2
c) Bột đá vôi CaCO3 và Na2CO3. Viết các phương trình phản ứng hóa học
Lời giải:
a) Dùng quỳ tím để nhận biết dung dịch H2SO4và dung dịch CuSO4
b) Dùng kẽm để nhận biết dung dịch HCl và dung dịch FeCl2
Hiện tượng: ống nghiệm nào có bọt khí sinh ra là dung dịch HCl, còn ống nghiệm không có bọt khí sinh ra là dung dịch FeCl2.
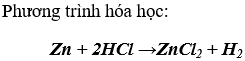
c) Dùng dung dịch H2SO4 loãng dư để nhận biết bột đá vôi CaCO3 và Na2CO3
Hiện tượng: ống nghiệm nào có khí bay ra, tan hết đó là Na2CO3, ống nghiệm nào có khí bay ra, không tan hết đó là CaCO3, vì CaSO4 (ít tan) sinh ra phủ lên CaCO3 làm cho CaCO3 không tan hết.
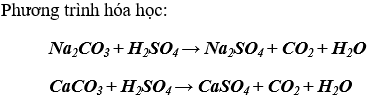
Bài 2. (Trang 140 VBT Hóa học 9 )
Có các chất sau: FeCl3, Fe2O3, Fe, Fe(OH)3, FeCl2. Hãy lập thành một dãy chuyển hóa và viết các phương trình hóa học. Ghi rõ điều kiện phản ứng.
Lời giải:
Dãy biến hóa có thể là: Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe→ FeCl2

Bài 3. (Trang 140 VBT Hóa học 9 )
Có muối ăn và các chất cần thiết. Hãy nêu hai phương pháp điều chế khí clo. Viết các phương trình hóa học.
Lời giải:
Cách 1: Điện phân dung dịch NaCl bão hòa có màng ngăn:
Phương trình hóa học: 
Cách 2: Điều chế theo sơ đồ chuyển hóa sau:
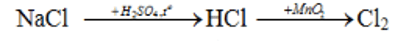
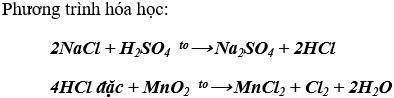
Bài 4. (Trang 140 VBT Hóa học 9 )
Có các bình đựng khí riêng biệt: CO2, Cl2, CO, H2
Hãy nhận biết mỗi khí trên bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
Lời giải:
Dùng quỳ tím ẩm để nhận biết được Cl2 và CO2
Hiện tượng: Khi nào làm quỳ tím ẩm chuyển sang màu đỏ, sau đó mất màu là khí clo. Khí nào làm quỳ tím ẩm chuyển sang màu đỏ là khí CO2
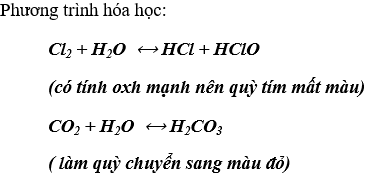
Đốt hai khí còn lại, nhận biết được CO và H2
Hiện tượng: cho sản phẩm qua nước vôi trong dư, khí nào làm đục nước vôi trong suy ra chất ban đầu là khí CO.
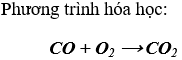
Bài 5. (Trang 140 VBT Hóa học 9 )
Cho 4,8g hỗn hợp A gồm Fe, Al2O3 tác dụng với dung dịch CuSO4 dư. Sau khi phản ứng kết thức, lọc lấy phần chất rắn không tan, rửa sạch bằng nước. sau đó cho phần chất rắn tác dụng với dung dịch HCl 1M thì còn lại 3,2g chất rắn màu đỏ.
a) Viết các phương trình hóa học
b) Tính thành phần phần trăm các chất trong hỗn hợp A ban đầu.
Lời giải:
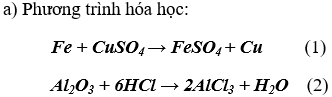
b) Chất rắn màu đỏ là đồng kim loại; Số mol là 0,05 mol
Số mol Fe tham gia phản ứng (1) là: nFe = nCu = 0,05 mol
Khối lượng Fe là: mFe = 0,05.56 = 2,8g
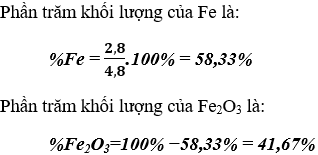
Bài 1. (Trang 141 VBT Hóa học 9 )
Dãy gồm các chất đều phản ứng với dd H2SO4 là
A. NaOH, MgO, CuCl2, Fe.
B. Ba(NO3)2, Fe2O3, Cu(OH)2, Zn.
C. Ba(OH)2, P2O5, Cu(NO3)2, Al.
D. FeCl2, Al2O3, KOH, Cu.
Lời giải:
Dãy B là dãy các chất đều tác dụng với dd H2SO4
Bài 2. (Trang 141 VBT Hóa học 9 )
Nhóm chất để làm sạch bạc cám ở dạng bột có lẫn tạp chất Cu, Fe, Al2O3, SiO2 là:
A. Dung dịch NaOH đặc, nóng, dung dịch axit HCl và nước.
B. Dung dịch HCl, dung dịch AgNO3 và nước.
C. Dung dịch NaOH đặc, nóng, dung dịch AgNO3 dư và nước.
D. Dung dịch KOH và dung dịch AgNO3 dư.
Lời giải:
Dùng nhóm dung dịch NaOH đặc, nóng, dung dịch AgNO3 dư và nước.
Bài 3. (Trang 141 VBT Hóa học 9 )
Có hỗn hợp các chất rắn: ZnCl2, Al, Fe, MgCO3. Hãy nêu phương pháp để xác định thành phần phần trăm về khối lượng của mỗi chất trong hỗn hợp.
Lời giải:
Phương pháp xác định là:
Bước 1: Cân hỗn hợp để biết khối lượng chính xác của cẩ hỗn hợp trên
Bước 2: Cho hỗn hợp vào dung dịch NaOH dư
- Thu khí hidro bay ra, đo chính xác thể tích khí → mAl → %mAl
- Lọc dung dịch lấy phần chất rắn không tan, chất rắn đó là: Fe, MgCO3.
- Sục khí CO2 dư vào dung dịch còn lại, thu được kết tủa Zn(OH)2. Cân chính xác khối lượng kết tủa Zn(OH)2 →mZnCl2 trong hỗn hợp ban đầu →%mZnCl2
Bước 3: Sục CO2 dư vào hỗn hợp chất rắn gồm Fe, MgCO3, sau phản ứng có phần chất rắn không tan, đó chính là Fe. Cân chính xác mFe → %mFe
Bước 4: Cho NaOH dư vào dung dịch thu được ở bước 3. Lọc kết tủa sau phản ứng, cân chính xác khối lượng kết tủa → %mMgCl2 ban đầu
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
- Giải SBT Hóa học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng (chính xác nhất)
- Giải SBT Hóa học 9 Bài 25: Tính chất của phi kim (chính xác nhất)
- Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
- Giải SBT Hóa học 9 Bài 55: Thực hành: Tính chất của gluxit (chính xác nhất)
- Giải SBT Hóa học 9 Bài 54: Polime (chính xác nhất)
- Giải SBT Hóa học 9 Bài 53: Protein (chính xác nhất)
- Giải SBT Hóa học 9 Bài 52: Tinh bột và xenlulozơ (chính xác nhất)