Giải SBT Hóa học 9 Bài 29: Axit cacbonic và muối cacbonat (chính xác nhất)
Mời thầy cô và các bạn học sinh tham khảo ngay Giải SBT Hóa 9 Bài 29: Axit cacbonic và muối cacbonat (ngắn gọn) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ nhất dưới đây.
Giải Hóa học 9 Bài 29 SBT: Axit cacbonic và muối cacbonat
Bài 29.1 trang 37 Sách bài tập Hóa học 9
Trộn dung dịch X với dung dịch Y, Thấy xuất hiện kết tủa. Dung dịch X, Y là :
A. NaOH và K2SO4; B. K2CO3 và Ba(NO3)2;
C. KCl và Ba(NO3)2 ; D. Na2CO3 và KNO3
Lời giải:
Đáp án B.
K2CO3 và Ba(NO3)2 → 2KNO3 + BaCO3↓
Bài 29.2 trang 37 Sách bài tập Hóa học 9
Dẫn khí cacbonic vào dung dịch natri hiđroxit. Sản phẩm có thể là chất nào ? Giải thích
Lời giải:
Dẫn CO2 vào dung dịch NaOH có 3 trường hợp xảy ra :
a) CO2 + NaOH → NaHCO3
b) CO2 + 2NaOH → Na2CO3 + H20
c) Cả hai phản ứng trên. Sản phẩm phản ứng là hỗn hợp NaHCO3 và Na2CO3.
Bài 29.3 trang 37 Sách bài tập Hóa học 9
Có những chất sau : NaHCO3, Ca(OH)2, CaCl2, CaCO3.
a) Chất nào tác dụng được với dung dịch HCl ?
b) Chất nào tác dụng được với dung dịch Na2CO3 ?
c) Chất nào tác dụng được với dung dịch NaOH ?
Viết các phương trình hoá học
Lời giải:
a) Các chất NaHCO3, Ca(OH)2, CaCO3 tác dụng với dung dịch HCl.
NaHCO3 + HCl → NaCl + H2O + CO2
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
CaCO3 + 2HCl → CaCl2 + H2O + CO2
b) Các chất CaCl2, Ca(OH)2 tác dụng với dung dịch Na2CO3.
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
c) Chất NaHCO3 tác dụng với dung dịch NaOH.
NaHCO3 + NaOH → Na2CO3 + H2O
Bài 29.4 trang 37 Sách bài tập Hóa học 9
Có hỗn hợp bột CaCO3 và CaSO4. Nêu cách để xác định thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp. Viết các phương trình hoá học, nếu có.
Lời giải:
Cân lấy một lượng hỗn hợp, thí dụ 10 gam đem ngâm trong dung dịch HCl dư, khuấy nhẹ. Nếu không còn khí thoát ra, nghĩa là lượng CaCO3 đã tham gia hết, còn lại chất rắn là CaSO4. Lọc lấy chất rắn, rửa sạch. Nung chất rắn trong chén sứ, để nguội và cân. Đó là khối lượng CaSO4 khan. Từ đó ta tính được tỉ lệ phần trăm các chất trong hỗn hợp ban đầu.
Bài 29.5 trang 37 Sách bài tập Hóa học 9
Viết các phương trình hoá học thực hiện những chuyển đổi hoá học sau :
Lời giải:
Các phương tình hóa học :
a)
(1) CaO + H2O → Ca(OH)2
(2) Ca(OH)2 + CO2 → CaCO3 + H2O
(3) CaCO3 to→ CaO + CO2
(4) CO2 + NaOH → NaHCO3
(5) CO2 + 2NaOH → Na2CO3 + H2O
b)
(1) MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
(2) MgSO4 + Na2CO3 → Na2SO4 + MgCO3
(3) MgCO3 + 2HCl → MgCl2 + CO2 + H2O
Bài 29.6 trang 37 Sách bài tập Hóa học 9
Hãy viết phương trình hoá học của các phản ứng sau :
(1) 2C + ... → 2CO
(2) Fe203 + ... → 2Fe + C02
(3) CO2 + ... → CaCO3 + H2O
Lời giải:
(1) 2C + O2 to→ 2CO
(2) Fe2O3 + 3CO to→ 2Fe + 3CO2
(3) CO2 + Ca(OH)2 → CaCO3 + H2O
Bài 29.7 trang 37 Sách bài tập Hóa học 9
Cho 19 gam hỗn hợp Na2CO3 và NaHCO3 tác dụng với 100 gam dung dịch HCl, sinh ra 4,48 lít khí (đktc).
Khối lượng mỗi muối trong hỗn hợp lần lượt là :
A. 10,6 gam và 8,4 gam ; B. 16 gam và 3 gam ;
C. 10,5 gam và 8,5 gam ; D. Kết quả khác.
Lời giải:
Đáp án A.
nNa2CO3 = x; nNaHCO3 = y; nCO2 = 0,2 mol
Phương trình hóa học :
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
NaHCO3 + HCl → NaCl + CO2 + H2O
Ta có hệ phương trình
x + y = 0,2
106x + 84y = 19
=> x = y = 0,1
mNa2CO3 = 10,6g; mNaHCO3 = 8,4g
Bài 29.8 trang 38 Sách bài tập Hóa học 9
Nung 150 kg CaC03 thu được 67,2 kg CaO. Hiệu suất của phản ứng là
A. 60% ; B. 40% ; C. 80% ; D. 50%.
Lời giải:
Đáp án C.
CaCO3 to→ CaO + CO2
Cứ 100g CaCO3 thì tạo ra 56g CaO
⇒ Khi dùng 150kg CaCO3 tạo ra: mCaO = 150.56/100 = 84 (kg)
H% = 67,2/84 x 100% = 80%
Bài 29.9 trang 38 Sách bài tập Hóa học 9
Nung nóng m gam hỗn hợp CaCO3 và MgCO3 đến phản ứng hoàn toàn, sau phản ứng thu được 2,72 gam hỗn hợp 2 oxit và 1344 ml khí CO2 (ở đktc). Hãy tính giá trị của m.
Lời giải:
Phương trình hóa học của phản ứng:
CaCO3 to→ CaO + CO2
MgCO3 to→ MgO + CO2
nCaCO3 = x; nMgCO3 = y
nCO2 = 1344/22400 = 0,06
Ta có hệ phương trình
56x + 40y = 2,72
x + y = 0,06
Giải ra, ta có: x = 0,O2(mol); y = 0,04(mol)
m = mCaCO3 + mMgCO3 = 0,O2 x 100 + 0,04 x 84 = 5,36g
Bài 29.10 trang 38 Sách bài tập Hóa học 9
Cho 1,06 gam muối cacbonat kim loại hoá trị I tác dụng hết với dung dịch HCl thấy thoát ra 224 mi khí cacbonic (ở đktc). Xác định công thức phân tử muối cacbonat.
Lời giải:
Gọi M là kí hiệu nguyên tử khối của kim loại hoá trị I. Công thức muối là M2C03. Phương trình hoá học của phản ứng :
M2CO3 + 2HCl → 2MCl2 + H2O + CO2
(2M + 60)g 22400ml
1,06g 224ml
Theo phương trình hóa học trên ta có:
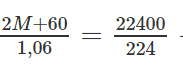
→ M = 23. Đó là muối Na2CO3
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa học 9 Bài 29: Axit cacbonic và muối cacbonat (chính xác nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
- Giải SBT Hóa học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng (chính xác nhất)
- Giải SBT Hóa học 9 Bài 25: Tính chất của phi kim (chính xác nhất)
- Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
- Giải SBT Hóa học 9 Bài 55: Thực hành: Tính chất của gluxit (chính xác nhất)
- Giải SBT Hóa học 9 Bài 54: Polime (chính xác nhất)
- Giải SBT Hóa học 9 Bài 53: Protein (chính xác nhất)
- Giải SBT Hóa học 9 Bài 52: Tinh bột và xenlulozơ (chính xác nhất)