Giải SBT Hóa học 9 Bài 36: Metan (chính xác nhất)
Mời thầy cô và các bạn học sinh tham khảo ngay Giải SBT Hóa 9 Bài 36: Metan (ngắn gọn nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ nhất dưới đây.
Giải Hóa học 9 Bài 36 SBT: Metan
Bài 36.1 trang 45 Sách bài tập Hóa học 9:
Trong tự nhiên khí metan có nhiều trong
A. khí quyển.
B. mỏ khí, mỏ dầu, mỏ than.
C. nước biển.
D. nước ao
Lời giải:
Đáp án B.
Bài 36.2 trang 45 Sách bài tập Hóa học 9:
Đốt cháy hoàn toàn 11,2 lít hỗn hợp khí gồm CH4 và H2 ở đktc thu được 16,2 gam H2O.
a) Viết các phương trình hoá học.
b) Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp.
c) Tính thể tích khí C02 tạo ra ở đktc.
Lời giải:
a) Các phương trình hóa học :
CH4 + 2O2 to→ CO2 + 2H2O
2H2 + O2 to→ 2H2O
Gọi x là số mol của CH4 => VCH4 = n.22,4 = 22,4x
y là số mol của H2 => VH2 = 22,4y
Vhh = VH2 + VCH4 => 22,4x + 22,4y = 11,2
nH2O = m/M = 16,2/18 = 0,9 mol
Phương trình hóa học :
CH4 + 2O2 to→ CO2 + 2H2O
2H2 + O2 to→ 2H2O
nH2O = 2x + y = 0,9
Từ (1) và (2), ta có hệ phương trình:
22,4x + 22,4y = 11,2
2x + y = 0,9
Giải hệ phương trình ta có: x = 0,4( mol); y= 0,1 mol
VCH4 = 22,4x = 22,4x0,4 = 8,96l
%VCH4 = 8,96/11,2 x 100% = 80%; VH2 = 100% - 80% = 20%
c) nCO2 = 0,4mol
Thể tích của khí CO2: VCO2 = 0,4 x 22,4 = 8,96l
Bài 36.3 trang 46 Sách bài tập Hóa học 9:
Ở điều kiện tiêu chuẩn, 2 lít hiđrocacbon A có khối lượng bằng 1 lít khí oxi. Hãy xác định công thức phân tử của A.
Lời giải:
Theo đề bài : 22,4 lít 02 có khối lượng bằng 44,8 lít hiđrocacbon A. Vậy 2 mol A có khối lượng bằng 1 mol oxi
=> MA = 16 gam => công thức phân tử của A là CH4.
Bài 36.4 trang 46 Sách bài tập Hóa học 9: Nêu phương pháp hoá học dùng để phân biệt các khí đựng trong các bình riêng biệt sau :
a) Metan, hiđro, oxi.
b) Metan, cacbon đioxit, hiđro.
c) Metan, cacbon oxit, hiđro.
Lời giải:
a) Đốt các khí:
Khí không cháy là oxi, khí cháy tạo ra CO2 (nhận được nhờ dung dịch Ca(OH)2) là CH4. Khí còn lại là H2.
b) Nhận ra CO2 nhờ dung dịch Ca(OH)2, phân biệt CH4 và H2 tương tự câu a.
c) Đốt các khí. Khí không sinh ra CO2 là H2. Hai khí cháy sinh ra CO2 đó là CH4 và CO.
Làm lạnh sản phẩm cháy khi đốt CH4 và CO, trường hợp nào sinh ra H20, đó là CH4. Khí con lại là CO.
Bài 36.5 trang 46 Sách bài tập Hóa học 9:
Propan là hiđrocacbon có tính chất tương tự metan và có công thức phân tử C3H8
a) Viết công thức cấu tạo của propan.
b) Viết phương trình hoá học của phản ứng đốt cháy propan.
c) Viết phương trình hoá học của phản ứng giữa propan và clo khi chiếu sá để tạo ra C3H7Cl.
Lời giải:
a) Công thức cấu tạo của C3H8
b) C3H8 + 5O2 to→ 3CO2 + 4H2O
c) C3H8 + Cl2 a/s→ C3H7Cl + HCl
Bài 36.6 trang 46 Sách bài tập Hóa học 9:
Khi cho metan tác dụng với clo có chiếu sáng theo tỉ lệ 1 : 1 về số mol, người thấy ngoài sản phẩm chính là CH3Cl còn tạo ra một hợp chất X trong phần trăm khối lượng của clo là 83,53%. Hãy xác định công thức phân tử của X.
Lời giải:
Sản phẩm tạo ra có công thức: CH4-aCla
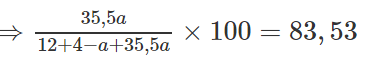
=> a = 2. Vậy công thức của X là CH2Cl2
Bài 36.7 trang 46 Sách bài tập Hóa học 9:
Hỗn hợp X gồm CH4 và hiđrocacbon A. Đốt cháy hoàn toàn 4,48 lít hỗn h X rồi cho toàn bộ sản phẩm thu được hấp thụ hết vào dung dịch Ca(OH)2 dư thấy tạo ra 50 gam kết tủa và khối lượng bình đựng dung dịch Ca(OH)2 tăng thêm 34,6 gam.
Xác định công thức phân tử của A, biết trong hỗn hợp số mol của A gấp lần số mol của CH4.
Lời giải:
nX = 4,48/22,4 = 0,2 mol
=> nCH4 = 0,2/4 = 0,05 mol; nA = 0,05 x 3 = 0,15 mol
Phương trình hóa học: CH4 + 2O2 → CO2 + 2H2O
CnHm + (n+m/4)O2 to→ nCO2 + m/2H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
nCO2 = nCaCO3 = 50/100 = 0,5 mol => nCO2, nH2O tạo ra khi đốt cháy A là
nCO2 = 0,5 - 0,05 = 0,45mol; nH2O = 0,7 - 0,1 = 0,6 mol
=> Công thức của A là C3H8
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa học 9 Bài 36: Metan (chính xác nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
- Giải SBT Hóa học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng (chính xác nhất)
- Giải SBT Hóa học 9 Bài 25: Tính chất của phi kim (chính xác nhất)
- Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
- Giải SBT Hóa học 9 Bài 55: Thực hành: Tính chất của gluxit (chính xác nhất)
- Giải SBT Hóa học 9 Bài 54: Polime (chính xác nhất)
- Giải SBT Hóa học 9 Bài 53: Protein (chính xác nhất)
- Giải SBT Hóa học 9 Bài 52: Tinh bột và xenlulozơ (chính xác nhất)