Giải SBT Hóa học 9 Bài 2: Một số oxit quan trọng (chính xác nhất)
Mời thầy cô và các bạn học sinh tham khảo ngay Giải SBT Hóa 9 Bài 2: Một số oxit quan trọng (ngắn gọn) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ nhất dưới đây.
Giải Hóa học 9 Bài 2 SBT: Một số oxit quan trọng
Bài 2.1 trang 4 Sách bài tập Hóa học 9
Kim loại M tác dụng với dung dịch HCl sinh ra khí hiđro. Dẫn khí hiđro đi qua oxit của kim loại N nung nóng. Oxit này bị khử cho kim loại N. M và N là
A. đồng và chì
B. chì và kẽm
C. kẽm và đồng
D. đồng và bạc
Lời giải:
Phương án C. Cặp kim loại kẽm và đồng (M là Zn, N là Cu)
Các phương trình hoá học :
Zn + 2HCl → ZnCl2 + H2
CuO + H2 to→ Cu + H2O
Bài 2.2 trang 4 Sách bài tập Hóa học 9
Canxi oxit tiếp xúc lâu ngày với không khí sẽ bị giảm chất lượng. Hãy giải thích hiện tượng này và minh hoạ bằng phương trình hoá học.
Lời giải:
CaO là oxit bazơ tác dụng với oxit axit CO2 trong không khí, tạo ra CaCO3 (đá vôi).
Phương trình hóa học
CaO + CO2 → CaCO3
Bài 2.3 trang 4 Sách bài tập Hóa học 9
Viết các phương trình hoá học thực hiện những chuyển đổi hoá học theo sơ đồ sau :
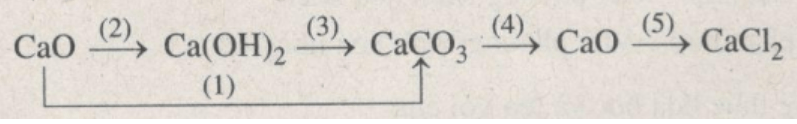
Lời giải:
1. CaO tác dụng với CO2.
CaO + CO2 → CaCO3
2. CaO tác dụng với H2O.
CaO + H2O → Ca(OH)2
3. Ca(OH)2 tác dụng với CO2 hoặc Na2CO3.
Ca(OH)2 + CO2 → CaCO3 + H2O
4. Phân huỷ CaCO3 ở nhiệt độ cao.
CaCO3 → CaO + CO2
5. CaO tác dụng với dung dịch HCl.
CaO + 2HCl → CaCl2 + H2O
Bài 2.4 trang 4 Sách bài tập Hóa học 9
CaO là oxit bazơ, P2O5 là oxit axit. Chúng đều là những chất rắn, màu trắng. Bằng những phương pháp hoá học nào có thể giúp ta nhận biết được mỗi chất trên ?
Lời giải:
Cho mỗi chất tác dụng với H2O, sau đó thử dung dịch bằng quỳ tím.
CaO tan trong nước tạo ra dung dịch Ca(OH)2 là dung dịch bazơ làm quỳ tím đổi sang màu xanh
P2O5 tan trong H2O tạo ra dung dịch H3PO4 là axit làm quỳ tím đổi sang màu đỏ
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Bài 2.5 trang 4 Sách bài tập Hóa học 9
Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống CaO, nếu hiệu suất là 85% ?
Lời giải:
Đáp số : 381 kg CaO
Hướng dẫn:
mCaCO3 = 80/100 x 1000 = 800(kg)
CaCO3 to→ CaO + CO2
Cứ 100kg CaCO3 thì tạo ra 56g CaO
⇒ Với 800kg CaCO3 tạo ra:
mCaO = 800 x 56/100 = 448(kg)
Khối lượng CaO thực tế: mCaO = 448x85/100 = 380,8 (kg)
Bài 2.6 trang 4 Sách bài tập Hóa học 9
Để tôi vôi, người ta đã dùng một khối lượng nước bằng 70% khối lượng vôi sống. Hãy cho biết khối lượng nước đã dùng lớn hơn bao nhiêu lần so với khối lượng nước tính theo phương trình hoá học.
Lời giải:
Theo phương trình hoá học : 56 kg CaO tác dụng với 18 kg H2O.
Thực tế thì khối lượng H2O dùng để tôi vôi sẽ là : 56x70/100 = 39,2(kg)
Khối lượng nước đã dùng lớn hơn là : 39,2/18 ≈ 2,2 (lần)
Bài 2.7 trang 4 Sách bài tập Hóa học 9
Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4).
a) Viết phương trình hoá học.
b) Xác định nồng độ mol của dung dịch axit thu được.
Lời giải:
a) Phương trình hoá học :
SO3 + H2O → H2SO4
b) Nồng độ mol của dung dịch H2SO4 :
nH2SO4 = nSO3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
CMdd H2SO4 = 1000x0,1/250 = 0,4M
Bài 2.8 trang 5 Sách bài tập Hóa học 9
Dẫn 1,12 lít khí lưu huỳnh đioxit (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M.
a) Viết phương trình hoá học.
b) Tính khối lượng các chất sau phản ứng.
Lời giải:
a) Phương trình hoá học :
SO2 + Ca(OH)2 → CaSO3 + H2O
b) Khối lượng các chất sau phản ứng :
Số mol các chất đã dùng :
nSO2 = 1,12/22,4 = 0,05 mol; nCa(OH)2 = 0,1x700/1000 = 0,07 mol
Theo phương trình hoá học, lượng Ca(OH)2 đã dùng dư. Do đó khối lượng các chất sau phản ứng được tính theo lượng SO2.
0,05 mol SO2 tác dụng với 0,05 mol Ca(OH)2 sinh ra 0,05 mol CaSO3 và dư 0,07 - 0,05 = 0,02 (mol) Ca(OH)2 .
Khối lượng các chất sau phản ứng là :
mCaSO3 = 120 x 0,05 = 6 (gam)
mCa(OH)2 = 74 x 0,02 = 1,48 (gam)
Bài 2.9 trang 5 Sách bài tập Hóa học 9
Có các chất sau :
A. CuO ; B . H2; C.CO; D. SO3; E. P2O5 ; G.H2O
Hãy chọn những chất thích hợp trong các chất trên điền vào chỗ trống trong các sơ đồ phản ứng sau :
... + H2O → H2SO4
H2O + ... v H3PO4
... + HCl → CuCl2 + H2O
... + H2SO4 → CuSO4 + ...
CuO + ... to→ Cu + H2O
Lời giải:
1. D. SO3 ; 4. A. CuO, G. H2O
2. E. P2O5 ; 5. B. H2.
3. A. CuO ;
Bài 2.10 trang 5 Sách bài tập Hóa học 9
Nung nóng 13,1 gam một hỗn hợp gồm Mg, Zn, Al trong không khí đến phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, ZnO, Al2O3 Hoà tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M.
a) Tính V.
b) Tính khối lượng muối clorua tạo ra.
Lời giải:
Ta có sơ đồ chuyển hoá :
Mg, Zn, Al O2→ MgO, ZnO, Al2O3
MgO + 2HCl → MgCl2 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO, ZnO, Al2O3 HCl→ MgCl2, ZnCl2, AlCl3
a) Ta có khối lượng O2 đã phản ứng : mO2 = 20,3 - 13,1 = 7,2 (g)
Vậy khối lượng oxi trong hỗn hợp oxit là 7,2 gam.
Toàn bộ lượng oxi trong oxit đã chuyển vào H2O nên ta có mO(H2O) = 7,2g
Cứ 1 mol H2O thì chứa 1 mol nguyên tử O ⇒ nH2O = nO = 7,2 : 16 = 0,45 mol
Từ phương trình ta có:
nHCl = 2nH2O = 2.0,45 = 0,9 mol
⇒ VHCl = 0,9/0,4 = 2,25l
b) Bảo toàn khối lượng: moxit + mHCl = mmuối + mH2O
⇒ 20,3 + 0,9.36,5 = mmuối + 0,45.18
⇒ mmuối = 45,05g
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa học 9 Bài 2: Một số oxit quan trọng (chính xác nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
- Giải SBT Hóa học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng (chính xác nhất)
- Giải SBT Hóa học 9 Bài 25: Tính chất của phi kim (chính xác nhất)
- Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
- Giải SBT Hóa học 9 Bài 55: Thực hành: Tính chất của gluxit (chính xác nhất)
- Giải SBT Hóa học 9 Bài 54: Polime (chính xác nhất)
- Giải SBT Hóa học 9 Bài 53: Protein (chính xác nhất)
- Giải SBT Hóa học 9 Bài 52: Tinh bột và xenlulozơ (chính xác nhất)