Giải SBT Hóa học 9 Bài 27: Cacbon (chính xác nhất)
Mời thầy cô và các bạn học sinh tham khảo ngay Giải SBT Hóa 9 Bài 27: Cacbon (ngắn gọn) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ nhất dưới đây.
Giải Hóa học 9 Bài 27 SBT: Cacbon
Bài 27.1 trang 33 Sách bài tập Hóa học 9
Người ta đã căn cứ vào tính chất vật lí và tính chất hoá học của than để sử dụng than trong thực tế đời sống như thế nào ? Cho thí dụ.
Lời giải:
- Dựa vào khả năng hấp phụ của than để hấp phụ các chất độc (dùng trong mặt nạ phòng độc), loại chất bẩn trong lọc đường, lọc dầu thực vật, làm xúc tác cho phản ứng giữa các chất khí.
- Phản ứng của than với oxi toả nhiều nhiệt cho nên từ lâu than được dùng làm chất đốt, làm nguyên liệu trong quá trình luyện quặng thành gang.
- Cacbon dùng làm chất khử : 3C + Fe2O3 → 3CO + 2Fe
Nhiệt độ càng cao, tính khử của cacbon càng mạnh. Người ta dùng cacbon để điều chế một số kim loại từ oxit của chúng.
Bài 27.2 trang 33 Sách bài tập Hóa học 9
Viết phương trình hoá học của các phản ứng sau và cho biết tính chất hoá học của cacbon (là chất oxi hoá hay chất khử)
(1) C + CO2 to→ CO (2) C + Fe2O3 to→ Fe + CO (3) C + CaO to→ CaC2 + CO (4) C + PbO to→ Pb + CO2 (5) C + CuO to→ Cu + CO2
Lời giải:
(1) C + CO2 to→ 2CO (2) 3C + Fe2O3 to→ 2Fe + 3CO (3) 3C + CaO to→ CaC2 + CO (4) C + 2PbO to→ 2Pb + CO2 (5) C + 2CuO to→ 2Cu + CO2
Trong các phản ứng trên C là chất khử
Bài 27.3 trang 33 Sách bài tập Hóa học 9
Trong quá trình luyện quặng sắt thành gang, người ta dùng CO làm chất khử. Hãy tính thể tích khí CO (đktc) có thể thu được từ 1 tấn than chứa 90% cacbon, nếu hiệu suất của cả quá trình phản ứng là 85%.
Lời giải:
Khối lượng cacbon trong 1 tấn than: 1000x90/100 = 900 tấn
2C + O2 → 2CO
2x12kg 2x22,4m3
900kg x m3
x = 900 x 2 x 22,4/(2x12) = 1680 (m3)
Thực tế, thể tích khí CO thu được là: 1680 x 85/100 = 1428 (m3)
Bài 27.4 trang 33 Sách bài tập Hóa học 9
Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
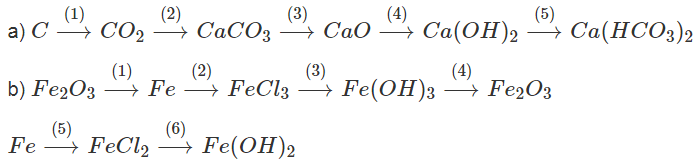
Lời giải:
Phương trình háo học :
a)
(1) C + O2 to→ CO2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) CaCO3 → CaO + CO2
(4) CaO + H2O → Ca(OH)2
(5) Ca(OH)2 + 2CO2 → Ca(HCO3)2
b)
(1) Fe2O3 + 3H2 → 2Fe + 3H2O
(2) 2Fe + 3Cl2 → 2FeCl3
(3) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
(4) 2Fe(OH)3 → Fe2O3 + 3H2O
(5) Fe + HCl → FeCl2 + H2
(6) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Bài 27.5 trang 34 Sách bài tập Hóa học 9
Cho hơi nước đi qua than nóng đỏ, người ta thu được hỗn hợp khí CO và H2 (hình 3.3).
a) Viết phương trình hoá học.
b) Tính thể tích hỗn hợp khí (đktc) thu được ở phản ứng trên khi dùng hết 1 tấn than chứa 92%
Lời giải:
a) Phương trình hóa học :
C + H2O to→ CO + H2
b) Thể tích hỗn hợp khí thu được.
Trong 1000 kg than có: 1000 x92/100 = 920 kg cacbon
C + H2O → CO + H2
12g 22,4l 22,4l
12kg 44,8m3
920kg 44,8x920/12 = 3434,7 (m3) hỗn hợp khí
Thể tích hỗn hợp khí thực tế thu được: 3434,7 x 85/100 = 2919,5 m3
Bài 27.6 trang 34 Sách bài tập Hóa học 9
Cho 268,8 m3 hỗn hợp khí CO và H2 khử sắt(III) oxit ở nhiệt độ cao.
a) Viết phương trình hoá học.
b) Tính khối lượng sắt thu được.
Lời giải:
a) Phương trình hóa học :
3CO + Fe2O3 to→ 3CO2 + 2Fe (1)
3H2 + Fe2O3 to→ 3H2O + 2Fe (2)
b) Tổng hợp (1) và (2) ta có :
Cứ 3 x 22,4 m3 hỗn hợp khí CO và H2 qua Fe2O3 thì thu được 2 x 56 kg Fe. 268,8 m3 hỗn hợp khí CO và H2 qua Fe2O3 thì thu được x kg Fe.
x = 268,8 x 2 x 56/(3x22,4) = 448(kg) Fe
Bài 27.7 trang 34 Sách bài tập Hóa học 9
Đem nung hỗn hợp hai oxit CuO và ZnO có tỉ lệ số mol là 1 : 1 với cacbon trong điều kiện thích hợp để oxit kim loại bị khử hết, thu được hỗn hợp chất rắn X. Cho X tác dụng với dung dịch HCl dư thấy thoát ra 2,24 lít khí (ở đktc). Hãy tính khối lượng mỗi oxit kim loại.
Lời giải:
Sơ đồ phản ứng: ZnO, CuO C→ Zn, Cu
Zn + 2HCl → ZnCl2 + H2
nH2 = 2,24/22,4 = 0,1 mol
nZn = 0,1 mol
Theo đề bài, ZnO, CuO có tỷ lệ số mol là 1:1 nên Zn và Cu cũng có tỉ lệ số mol 1:1
=> nCu = nZn = 0,1 mol
mCuO = 8g; mZnO = 8,1g
►►► CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa học 9 Bài 27: Cacbon (chính xác nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 9 Bài 18: Nhôm (chính xác nhất)
- Giải SBT Hóa học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng (chính xác nhất)
- Giải SBT Hóa học 9 Bài 25: Tính chất của phi kim (chính xác nhất)
- Giải SBT Hóa học 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ (chính xác nhất)
- Giải SBT Hóa học 9 Bài 55: Thực hành: Tính chất của gluxit (chính xác nhất)
- Giải SBT Hóa học 9 Bài 54: Polime (chính xác nhất)
- Giải SBT Hóa học 9 Bài 53: Protein (chính xác nhất)
- Giải SBT Hóa học 9 Bài 52: Tinh bột và xenlulozơ (chính xác nhất)