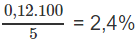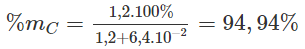Giải SBT Hóa Học 11 Bài 15: Cacbon (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 11 Bài 15: Cacbon (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 11 Bài 15 SBT: Cacbon
Bài 15.1 trang 22 sách bài tập Hóa 11
Trong những nhận xét dưới đây, nhận xét nào không đúng?
A. Kim cương là cacbon hoàn toàn tinh khiết, trong suốt, không màu, không dẫn điện.
B. Than chì mềm do có cấu trúc lớp, các lớp lân cận liên kết với nhau bằng lực tương tác yếu.
C. Than gỗ, than xương có khả năng hấp phụ các chất khí và chất tan trong dung dịch.
D. Khi đốt cháy cacbon, phản ứng toả nhiều nhiệt, sản phẩm thu được chỉ là khí cacbonic.
Lời giải:
Đáp án: D.
Bài 15.2 trang 22 sách bài tập Hóa 11
Loại than nào sau đây không có trong thiên nhiên?
A. Than chì
B. Than antraxit
C. Than nâu
D. Than cốc
Lời giải:
Đáp án: D.
Bài 15.3 trang 22 sách bài tập Hóa 11
Loại than nào sau đây được dùng trong mặt nạ phòng độc?
A. than chì
B. than cốc
C. than hoạt tính
D. than muội
Lời giải:
Đáp án: C.
Bài 15.4 trang 22 sách bài tập Hóa 11
Nhận xét nào sau đây về tính chất hóa học của cacbon là đúng?
A. Cacbon không thể hiện tính oxi hóa và tính khử.
B. Cacbon thể hiện tính oxi hóa và tính khử với mức độ ngang nhau.
C. Cacbon thể hiện tính oxi hóa và tính khử nhưng tính oxi là tính chất chủ yếu.
D. Cacbon thể hiện tính oxi hóa và tính khử nhưng tính khử là tính chất chủ yếu.
Lời giải:
Đáp án: D.
Bài 15.5 trang 22 sách bài tập Hóa 11
Ở nhiệt độ cao cacbon có thể phản ứng với nhiều đơn chất và hợp chất. Hãy lập các phương trình hoá học sau đây và cho biết ở phản ứng nào cacbon thể hiện tính khử. Ghi rõ số oxi hoá của cacbon trong từng phản ứng.
1. C + S →
2. C + Al →
3. C + Ca →
4. C + H2O →
5. C + CuO →
6. C + HNO3(đặc) →
7. C + H2SO4(đặc) →
8. C + KClO3 →
9. C + CO2 →
Lời giải:
1. C + S → CS2
0 +4
2. C + Al → Al4C3
0 -4
3. C + Ca → CaC2
0 -1
4. C + H2O → CO + H2
0 +2
5. C + CuO → 2Cu + CO2
0 +4
6. C + HNO3(đặc) → CO2 + 4NO2 + 2H2O
0 +4
7. C + H2SO4(đặc) → CO2 + 2SO2 + 2H2O
0 +4
8. C + KClO3 → 2KCl + 3CO2
0 +4
9. C + CO2 → 2CO
0 +2
Cabon thể hiện tính khử ở các phản ứng: 1, 4, 5, 6, 7, 8, 9.
Bài 15.6 trang 23 sách bài tập Hóa 11
Để xác định hàm lượng phần trăm cacbon trong một mẫu gang trắng, người ta đốt mẫu gang trong oxi dư. Sau đó, xác định lượng khí CO2 tạo thành bằng cách dẫn khí qua nước vôi trong dư ; lọc lấy kết tủa, rửa sạch, sấy khô rồi đem cân. Với một mẫu gang khối lượng là 5,00 g và khối lượng kết tủa thu được là 1,00 g thì hàm lượng (%) cacbon trong mẫu gang là bao nhiêu ?
Lời giải:
Khi đốt mẫu gang trong oxi, cacbon cháy tạo thành CO2. Dẫn CO2 qua nước vôi trong dư, toàn bộ lượng CO2 chuyển thành kết tủa CaCO3.
C + O2 to→ CO2 (1)
CO2 + Ca(OH)2 → CaCO3↑ + H2O (2)
Theo các phản ứng (1) và (2): nC = nCO2 = nCaCO3 = 0,01 (mol)
Khối lượng cacbon: mC = 0,01.12 = 0,12 (g)
Hàm lượng (%) cacbon trong mẫu gang:
%C =
Bài 15.7 trang 23 sách bài tập Hóa 11
Đốt một mẫu than chì chứa tạp chất lưu huỳnh trong oxi. Cho hỗn hợp khí thoát ra tác dụng với lượng dư dung dịch brom, thấy có 0,32 g brom đã phản ứng. Cho khí thoát ra khỏi dung dịch brom tác dụng với lượng dư nước vôi trong, thu được 10,00 g kết tủa.
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Xác định phần trăm khối lượng của cacbon trong mẫu than chì.
Lời giải:
1. Các phương trình hóa học :
C + O2 to→ CO2 (1)
S + O2 to→ SO2 (2)
Khi đi vào dung dịch brom chỉ có SO2 phản ứng :
SO2 + Br2 + 2H2O → H2SO4 + 2HBr (3)
Khí CO2 thoát ra khỏi dung dịch brom tác dụng với nước vôi trong :
CO2 + Ca(OH)2 → CaCO3drarr; + H2O (4)
2. Theo các phản ứng (2) và (3):
nS = nSO2 = nBr2 = 2.10-3 (mol).
Khối lượng lưu huỳnh trong mẫu than chì: mS = 200.10-3.32 = 6,4.10-2 (g).
Theo các phản ứng (1) và (4):
nC = nCO2 = nCaCO3 = 0,1 (mol).
Khối lượng cacbon trong mẫu than chì :
mC = 0,1.12 = 1,20 (g).
Phần trăm khối lượng cacbon trong mẫu than chì :
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 11 Bài 15: Cacbon (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa Học 11 Bài 45: Axit cacboxylic (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 41: Phenol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 40: Ancol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 36: Luyện tập: Hiđrocacbon thơm (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 33: Luyện tập: Ankin (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 31: Luyện tập: Anken và ankađien (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 44: Anđehit - Xeton (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 42: Luyện tập: Dẫn xuất halogen, ancol, phenol