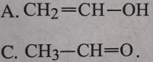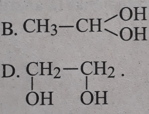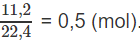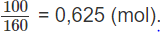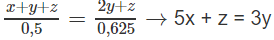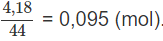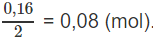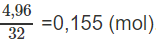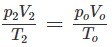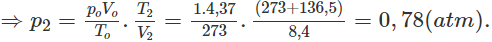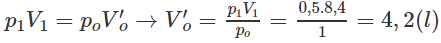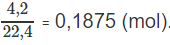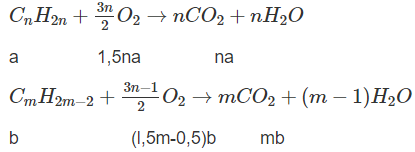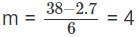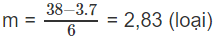Giải SBT Hóa Học 11 Bài 33: Luyện tập: Ankin (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn Giải SBT Hóa học 11 Bài 33: Luyện tập: Ankin (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 11 Bài 33 SBT: Luyện tập: Ankin
Bài 33.1 trang 51 sách bài tập Hóa 11
1. Công thức phân tử nào cho dưới đây phù hợp với penten?
A. C5H8
B. C5H10
C. C5H12
D. C3H6
2. Hợp chất nào dưới đây là ankin ?
A. C2H2
B. C8H8
C. C4H4
D. C6H6
3. Gốc nào dưới đây là ankyl ?
A. -C3H5
B. -C6H5
C. -C2H3
D. -C2H5
Lời giải:
Đáp án: 1 - B, 2 - A, 3 - D
Bài 33.2 trang 51 sách bài tập Hóa 11
1. Trong 4 chất sau, chất nào có nhiệt độ sôi cao nhất là ?
A. eten.
B. propen.
C. but-1-en.
D. pent-1-en.
2. Chất nào dưới đây không tác đụng với dung dịch AgNO3 trong amoniac?
A. but-1-in
B. but-2-in
C. propin
D. etin
3. Chất nào sau đây không tác dụng với Br2 (tan trong CCl4) là?
A. but-1-in.
B. but-1-en.
C. xiclobutan.
D. xiclopropan.
Lời giải:
Đáp án: 1 - D, 2 - B, 3 - C
Bài 33.3 trang 51 sách bài tập Hóa 11
Cho propin tác dụng với HCl theo hai gian đoạn liên tiếp thì sản phẩm chính thu được là:
A. CH3-CHCl-CH2Cl.
B. CH3-CH2-CHCl2.
C. ClCH2-CH2-CH2Cl.
D. CH3-CCl2-CH3.
Lời giải:
Đáp án: D.
Bài 33.4 trang 51 sách bài tập Hóa 11
Cho axetilen phản ứng cộng với nước, xúc tác là HgSO4 và H2SO4 thì sản phẩm cuối cùng thu được là
Lời giải:
Đáp án: C.
Bài 33.5 trang 51 sách bài tập Hóa 11
Viết phương trình hoá học của các phản ứng xảy ra trong quá trình điều chế PVC xuất phát từ các chất vô cơ: CaO, HCl, H2O, C.
Lời giải:
Phương trình hóa học:
CaO + 3C 2000oC→ CaC2 + CO
CaCl2 + 2H2O → Ca(OH)2 + C2H2↑
CH≡CH + HCl 150-200oC, HgCl2→ CH2=CH-Cl
nCH2=CH-Cl to, xt, p → (CH2-CHCl)n
Bài 33.6 trang 52 sách bài tập Hóa 11
Hỗn hợp khí A chứa metan, axetilen và propen. Đốt cháy hoàn toàn 11 g hỗn hợp A, thu được 12,6 g H2O. Mặt khác, nếu dẫn 11,2 lít A (đktc) qua nước brom (lấy dư) thì khối lượng brom nguyên chất phản ứng tối đa là 100 g.
Hãy xác định thành phần phần trăm theo khối lượng và theo thể tích của từng chất trong hỗn hợp A.
Lời giải:
Giả sử trong 11 gam hỗn hợp A có x mol CH4, y mol C2H2 và z mol C3H6:
16x + 26y + 42z = 11 (1)
Khi đốt cháy 11 g A :
CH4 + 2O2 → CO2 + 2H2O
x mol 2x mol
2C2H2 + 5O2 → 4CO2 + 2H2O
y mol y mol
2C3H6 + 9O2 → 6CO2 + 6H2O
z mol 3z mol
Số mol H2O:
2x + y + 3z = 0,7 (mol) (2)
Số mol A được dẫn qua nước brom là:
Số mol Br2 đã dự phản ứng:
Nếu dẫn 11 g A đi qua nước brom :
CH4 không phản ứng
x mol
C2H2 + 2Br2 → C2H2Br4
y mol 2y mol
C3H6 + Br2 → C3H6Br2
z mol z mol
Như vậy: (x + y + z) mol A tác dụng với (2y + z) mol Br2, 0,500 mol A tác dụng với 0,625 mol Br2
Giải hệ phương trình, tìm được x = 0,1; y = 0,2; z = 0,1
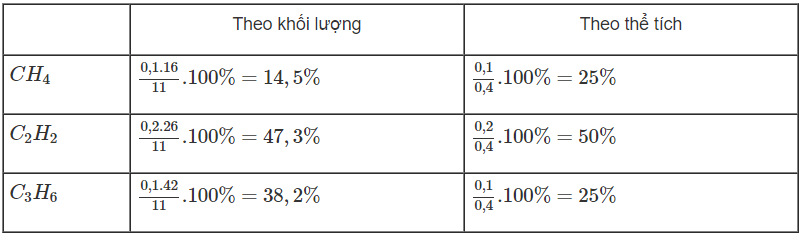
Thành phần phần trăm các chất trong hỗn hợp A:
Bài 33.7 trang 52 sách bài tập Hóa 11
Một bình kín dung tích 8,4 lít có chứa 4,96 g 02 và 1,3 gam hỗn hợp khí A gồm 2 hiđrocacbon. Nhiệt độ trong bình t1 = 0oC và áp suất trong bình p1 = 0,5 atm.
Bật tia lửa điện trong bình kín đó thì hỗn hợp A cháy hoàn toàn. Sau phản ứng, nhiệt độ trong bình là t2 = 136,5oC và áp suất là p2 atm. Dẫn các chất trong bình sau phản ứng đi qua bình thứ nhất đựng H2SO4 đặc, sau đó qua bình 2 đựng dung dịch NaOH (có dư) thì khối lượng bình thứ hai tăng 4,18 g.
1. Tính p2, biết rằng thể tích bình không đổi.
2. Xác định công thức phân tử và phần trăm theo thể tích của từng chất trong hỗn hợp A nếu biết thêm rằng trong hỗn hợp đó có một chất là anken và một chất là ankin.
Lời giải:
H2SO4 + nH2O → H2SO4.nH2O
2NaOH + CO2 → Na2CO3 + H2O
Số mol CO2 là:
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol H2O sau phản ứng là:
Để tạo ra 0,095 mol CO2 cần 0,095 mol O2;
Để tạo ra 0,08 mol H2O cần 0,04 (mol) O2.
Số mol O2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol O2 ban đầu là:
Số mol O2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì Vo = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
Số mol khí trước phản ứng:
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng CnH2n là a mol, lượng CmH2m-2 là b mol, ta có a + b = 0,0325.
Số mol O2: l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol CO2: na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
1,75.10−2n + 1,5.10−2m = 9,5.10−2
7n + 6m = 38
Nếu n = 2 thì
Nếu n = 3 thì
Nếu n > 3 thì m < 2 (loại).
% về thể tích của C2H4:
% về thể tích của C4H6 là 46,2%
Bài 33.8 trang 52 sách bài tập Hóa 11
Trình bày phương pháp hoá học để phân biệt các hiđrocacbon sau :
1. axetilen và metan;
2. axetilen và etilen;
3. axetilen, etilen và metan;
4. but-1-in và but-2-in.
Lời giải:
1. Dùng phản ứng với nước brom.
2. Dùng phản ứng với dung dịch AgNO3 trong amoniac.
3. Dùng phản ứng với dung dịch AgNO3 trong amoniac sau đó dùng phản ứng với nước brom.
4. Dùng phản ứng với dung dịch AgNO3 trong amoniac.
Bài 33.9 trang 52 sách bài tập Hóa 11
Cho biết phương pháp làm sạch chất khí:
1. metan lẫn tạp chất là axetilen và etilen ;
2. etilen lẫn tạp chất là axetilen.
Lời giải:
1. Dẫn hỗn hợp khí đi qua nước brom (lấy dư). Sau đó dẫn metan đi qua H2SO4 đặc để làm khô.
2. Dẫn hỗn hợp khí đi qua lượng dư dung dịch AgNO3 trong amoniac. Sau đó dẫn etilen đi qua H2SO4 đặc để làm khô.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 11 Bài 33: Luyện tập: Ankin (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa Học 11 Bài 45: Axit cacboxylic (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 41: Phenol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 40: Ancol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 36: Luyện tập: Hiđrocacbon thơm (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 33: Luyện tập: Ankin (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 31: Luyện tập: Anken và ankađien (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 44: Anđehit - Xeton (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 42: Luyện tập: Dẫn xuất halogen, ancol, phenol