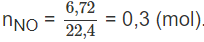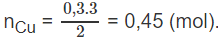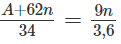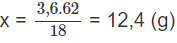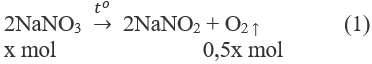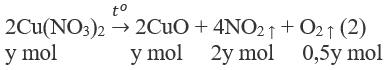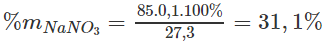Giải SBT Hóa Học 11 Bài 9: Axit nitric và muối nitrat (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 11 Bài 9: Axit nitric và muối nitrat (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 11 Bài 9 SBT: Axit nitric và muối nitrat
Bài 9.1 trang 14 sách bài tập Hóa 11
Nhận xét nào sau đây là đúng?
A. Trong HNO3, nitơ có 5 liên kết cộng hóa trị.
B. Trong HNO3, nitơ có hóa trị V.
C. Trong HNO3, nitơ có số oxi hóa +5.
D. Axit nitric là axit mạnh và bền.
Lời giải:
Đáp án: C.
Bài 9.2 trang 14 sách bài tập Hóa 11
Dãy nào sau đây chứa tất cả các chất đều phản ứng được với axit nitric khi có đủ các điều kiện cần thiết?
A. CaCO3, CuO, Au, C
B. AgCl, Fe2O3, Zn, S
C. Ba(OH)2, ZnO, Pt, P
D. Fe(OH)3, Al2O3, Cu, SO2
Lời giải:
Đáp án: D.
Bài 9.3 trang 14 sách bài tập Hóa 11
Khi đun nóng, phản ứng giữa cặp chất nào sau đây tạo ra ba oxit ?
A. Axit nitric đặc và cacbon
B. Axit nitric đặc và lưu huỳnh
C. Axit nitric đặc và đồng
D. Axit nitric đặc và bạc
Lời giải:
Đáp án: A.
Bài 9.4 trang 14 sách bài tập Hóa 11
Khi hoà tan 30,0 g hỗn hợp đồng và đồng(II) oxit. trong dung dịch NHO3 1,00 M lấy dư, thấy thoát ra 6,72 lít khí NO (đktc). Khối lượng của đồng (II) oxit trong hỗn hợp ban đầu là
A. 1,2 g.
B. 4,25 g.
C. 1,88 g .
D. 2,52 g.
Lời giải:
Đáp án: A.
Hướng dẫn:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
Số mol khí NO:
Theo phản ứng (1) số mol Cu:
Khối lượng Cu trong hỗn hợp ban đầu : mCu = 0,45.64 = 28,8 (g).
Khối lượng CuO trong hỗn hợp ban đầu : mCuO = 30 - 28,8 = 1,2 (g).
Bài 9.5 trang 14 sách bài tập Hóa 11
Hoàn thành các phương trình hoá học sau đây:
1. Fe + HNO3(đặc) to→ NO2↑ + ? + ?
2. Fe + HNO3(loãng) → NO↑ + ? + ?
3. FeO + HNO3(loãng) → NO↑ + ? + ?
4. Fe2O3 + HNO3(loãng) → ? + ?
5. FeS + H+ + NO3- → N2O↑ + ? + ? + ?
Lời giải:
1. Fe + 6HNO3 (đặc) to→ 3NO2↑ + Fe(NO3)3 + 3H2O
2. Fe + 4HNO3(loãng) → NO↑ + Fe(NO3)3 + 2H2O
3. 3FeO + 10HNO3(loãng) → NO↑ + 3Fe(NO3)3 + 5H2O
4. Fe2O3 + 6HNO3(loãng) → 2Fe(NO3)3 + 3H2O
5. 8FeS + 26H+ + 18NO3− → 9N2O↑ + 8Fe3+ + 8SO42− + 13H2O
Bài 9.6 trang 15 sách bài tập Hóa 11
Cho tan bột kẽm tác dụng với dung dịch HNO3 loãng, dư, thu được dung dịch A và hỗn hợp khí gồm N2 và N2O. Thêm NaOH dư vào dung dịch A, thấy có khí mùi khai thoát ra. Viết phương trình hoá học tất cả các phản ứng xảy ra dưới dạng phương trình ion rút gọn.
Lời giải:
5Zn + 12H+ + 2NO3− → 5Zn2+ + N2↑ + 6H2O
4Zn + 10H+ + 2NO3− → 4Zn2+ + N2O↑ + 5H2O
4Zn + 10H+ + NO3− → 4Zn2+ + NH4+ + 3H2O
Dung dịch A có các ion Zn2+, NH4+, H+ và NO3−.
Các phản ứng hoá học xảy ra khi thêm NaOH dư :
H+ + OH− → H2O
NH4+ + OH− → NH3↑ + H2O (mùi khai)
Zn2+ + 2OH− → Zn(OH)2↓
Zn(OH)2 + 2OH− → ZnO22− + 2H2O
Bài 9.7 trang 15 sách bài tập Hóa 11
Có các chất sau đây : NO2, NaNO3, HNO3, Cu(NO3)2, KNO2, KNO3. Hãy lập một dãy chuyển hoá biểu diễn mối quan hệ giữa các chất đó. Viết các phương trình hoá học và ghi điều kiện phản ứng, nếu có.
Lời giải:
Dãy chuyển hoá biểu diễn mối quan hệ giữa các chất có thể là :
KNO2 (1)← KNO3 (2)→ HNO3 (3)→ Cu(NO3)2 (4)→ NO2 (5)→ NaNO3
Các phương trình hoá học :
(1) 2KNO3 to→ 2KNO2 + O2↑
(2) KNO3(r) + H2SO4(đặc) to→ HNO3(đặc) + KHSO4(dd)
(3) 2HNO3 + Cu(OH)2 → Cu(NO3)2 + 2H2O
(4) 2Cu(NO3)2 to→ 2CuO + 4NO2 + O2
(5) 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
Bài 9.8 trang 15 sách bài tập Hóa 11
Khi cho oxit của một kim loại hoá trị n tác dụng với dung dịch NHO3 dư thì tạo thành 34,0 g muối nitrat và 3,6 g nước (không có sản phẩm khác). Hỏi đó là oxit của kim loại nào và khối lượng của oxit kim loại đã phản ứng là bao nhiêu ?
Lời giải:
Phản ứng chỉ tạo ra muối nitrat và nước, chứng tỏ n là hoá trị duy nhất của kim loại trong oxit. Đặt công thức của oxit kim loại là M2On và nguyên tử khối của M là A.
Phương trình hoá học :
M2On + 2nHNO3 → 2M(NO3)n + nH2O (1)
Theo phản ứng (1), khi tạo thành 1 mol [tức (A + 62n gam)] muối nitrat thì đồng thời tạo thành 0,5 mol (tức 9n gam) nước.
(A + 62n) gam muối nitrat - 9n gam nước
34 gam muối nitrat - 3,6 gam nước
Ta có tỉ lệ:
Giải phương trình được A = 23n. Chỉ có nghiệm n = 1, A = 23 là phù hợp. Vậy kim loại M trong oxit là natri.
Phản ứng giữa Na2O và HNO3:
Na2O + 2HNO3 → 2NaNO3 + H2O (2)
Theo phản ứng (2) :
Cứ tạo ra 18 gam H2O thì có 62 gam Na2O đã phản ứng
Vậy tạo ra 3,6 gam H2O thì có x gam Na2O đã phản ứng
Bài 9.9 trang 15 sách bài tập Hóa 11
Trong những nhận xét dưới đây về muối nitrat của kim loại, nhận xét nào không đúng ?
A. Tất cả các muối nitrat đều dễ tan trong nước.
B. Các muối nitrat đều là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat.
C. Các muối nitrat đều dễ bị phân huỷ bởi nhiệt.
D. Các muối nitrat chỉ được sử dụng làm phân bón hoá học trong nông nghiệp.
Lời giải:
Đáp án: D.
Bài 9.10 trang 15 sách bài tập Hóa 11
Dãy nào sau đây bao gồm các muối nitrat khi bị nhiệt phân đều tạo ra oxit kim loại?
A. Cu(NO3)2, Zn(NO3)2, Hg(NO3)2.
B. Fe(NO3)3, Cu(NO3)2, Ca(NO3)2.
C. Ba(NO3)2, Pb(NO3)2, Cu(NO3)2.
D. Mg(NO3)2, Fe(NO3)3, Pb(NO3)2.
Lời giải:
Đáp án: D.
Bài 9.11 trang 15 sách bài tập Hóa 11
Viết các phương trình hoá học thể hiện chuyển hoá muối natri nitrat thành muối kali nitrat, biết có đầy đủ hoá chất để sử dụng cho quá trình chuyển hoá đó.
Lời giải:
Đầu tiên điều chế HNO3 từ muối NaNO3, sau đó cho HNO3 phản ứng với KOH vừa đủ để tạo ra muối KNO3.
Các phương trình hoá học :
NaNO3(r) + H2SO4 (đặc) to→ HNO3(đặc) + NaHSO4
HNO3(dd) + KOH(dd) → KNO3(dd) + H2O
Cô cạn để đuổi nước, thu lấy KNO3.
Bài 9.12 trang 16 sách bài tập Hóa 11
Có năm lọ không dán nhãn đựng riêng từng dung dịch của các chất sau đây: Al(NO3)3, NH4NO3, AgNO3, FeCl3, KOH. Không được dùng thêm thuốc thử nào khác, hãy nêu cách nhận biết chất đựng trong mỗi lọ. Viết phương trình hoá học của các phản ứng đã được dùng để nhận biết.
Lời giải:
Nhận biết được dung dịch FeCl3 do có màu vàng, các dung dịch còn lại đều không màu.
- Nhỏ dung dịch FeCl3 vào từng dung dịch trong ống nghiêm riêng. Nhận ra được dung dịch AgNO3 do xuất hiện kết tủa trắng AgCl và nhận ra được dung dịch KOH do tạo thành kết tủa Fe(OH)3 màu nâu đỏ :
FeCl3 + 3AgNO3 → 3AgCl↓ + Fe(NO3)3
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
- Nhỏ từ từ dung dịch KOH vừa nhận biết được cho đến dư vào từng dung dịch còn lại là Al(NO3)3 và NH4NO3:
Ở dung dịch nào xuất hiện kết tủa keo màu trắng, sau đó kết tủa keo tan khi thêm dung dịch KOH, dung dịch đó là Al(NO3)3 :
Al(NO3)3 + 3KOH → Al(OH)3↓ + 3KNO3
Al(OH)3 + KOH → KAlO2(dd) + 2H2O
Ở dung dịch nào có khí mùi khai bay ra khi đun nóng nhẹ, dung dịch đó là NH4NO3:
NH4NO3 + KOH to→ KNO3 + NH3↑ + H2O (mùi khai)
Bài 9.13 trang 16 sách bài tập Hóa 11
Để nhận biết ion NO3− trong dung dịch, có thể dùng kim loại nhôm khử ion NO3− trong môi trường kiềm. Khi đó phản ứng tạo ra ion aluminat AlO2− và giải phóng khí amoniac. Hãy viết phương trình hoá học ở dạng ion rút gọn.
Lời giải:
Phương trình hoá học ở dạng ion rút gọn :
8Al + 3NO3− + 5OH− + 2H2O → 8AlO2− + 3NH3↑
Bài 9.14 trang 16 sách bài tập Hóa 11
Nhiệt phân hoàn toàn 27,3 g một hỗn hợp rắn X gồm NaNO3 và Cu(NO3)2, thu được hỗn hợp khí có thể tích 6,72 lít (đktc).
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Tính thành phần % về khối lượng của mỗi muối trong hỗn hợp X.
Lời giải:
1. Phương trình hoá học của các phản ứng:
2. Đặt X và y là số mol của NaNO3 và Cu(NO3)2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất NaNO3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
%mCu(NO3)2 = 100% - 31,1% = 68,9%
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 11 Bài 9: Axit nitric và muối nitrat (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa Học 11 Bài 45: Axit cacboxylic (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 41: Phenol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 40: Ancol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 36: Luyện tập: Hiđrocacbon thơm (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 33: Luyện tập: Ankin (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 31: Luyện tập: Anken và ankađien (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 44: Anđehit - Xeton (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 42: Luyện tập: Dẫn xuất halogen, ancol, phenol