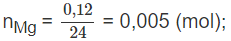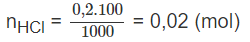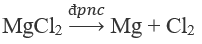Giải SBT Hóa Học 11 Bài 5: Luyện tập (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 11 Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 11 Bài 5 SBT: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài 5.1 trang 8 sách bài tập Hóa 11
Một mẫu nước mưa có pH = 4,82. Vậy nồng độ H+ trong đó là :
A. [H+] = 1.10-4M.
B. [H+] = 1.10-5M.
C. [H+] > 1.10-5M.
D. [H+] < 1.10-5M.
Lời giải:
Đáp án: C.
Bài 5.2 trang 8 sách bài tập Hóa 11
Dung dịch axit mạnh một nấc X nồng độ 0,010 mol/l có pH = 2 và dung dịch bazơ mạnh một nấc Y nồng độ 0,010 mol/l có pH = 12. Vậy:
A. X và Y là các chất điện li mạnh.
B. X và Y là các chất điện li yếu.
C. X là chất điện li mạnh, Y là chất điện li yếu.
D. X là chất điện li yếu, Y là chất điện li mạnh.
Lời giải:
Đáp án: A.
Bài 5.3 trang 8 sách bài tập Hóa 11
Dung dịch axit mạnh H2SO4 0,10M có :
A. pH = 1.
B. pH < 1.
C. pH > 1.
D. [H+] > 0,2M.
Lời giải:
Đáp án: B.
Bài 5.4 trang 8 sách bài tập Hóa 11
Dung dịch chất A có pH = 3. Cần thêm V2 ml nước vào V1 ml dung dịch chất A để pha loãng thành dung dịch có pH = 4. Biểu thức liên hệ giữa V1 và V2 là
A. V2 = 9V1
B. V2 = 10V1
C. V1 = 9V2
D. V2 = V1/10
Lời giải:
Đáp án: A.
Bài 5.5 trang 8 sách bài tập Hóa 11
Nồng độ H+ trong rượu vang là 3,2.10-4M. Sau khi mở nút chai để hở trong không khí một tháng, nồng độ H+ là 1.10-3M. Hỏi pH của rượu vang tăng lên hay giảm xuống sau khi để trong không khí ?
Lời giải:
Hướng dẫn: Giảm xuống.
Bài 5.6 trang 8 sách bài tập Hóa 11
Viết phương trình dạng phân tử ứng với phương trình ion rút gọn sau:
1. Ba2+ + CO32− → BaCO3↓
2. Fe3+ + 3OH− → Fe(OH)3↓
3. NH4+ + OH− → NH3↑ + H2O
4. S2− + 2H+ → H2S↑
5. HClO + OH− → ClO- + H20
6. CO2 + 2OH− → CO32− + H2O
Lời giải:
1. BaSO4 + Na2CO3 → BaCO3 + Na2SO4
2. 2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3 + 3BaCl2
3. (NH4)2SO4 + 2KOH → 2NH3 + 2H2O + K2SO4
4. FeS + 2HCl → H2S + FeCl2
5. NaOH + HClO → NaClO + H2O
6. CO2 + 2NaOH → Na2CO3 + H2O
Bài 5.7 trang 8 sách bài tập Hóa 11
Viết phương trình dạng phân tử và ion rút gọn của các phản ứng trong dung dịch theo sơ đồ sau:
1. Pb(NO3)2 + ? → PbCl2↓ + ?
2. Sn(OH)2 + ? → Na2SnO2↓ + ?
3. MgCO3 + ? → MgCl2 + ?
4. HPO42− + ? → H3PO4 + ?
5. FeS + ? → FeCl2 + ?
6. Fe2(SO4)3 + ? → K2SO4 + ?
Lời giải:
1. Pb(NO3)2 + 2KCl → PbCl2 + 2KNO3
2. Sn(OH)2 + 2NaOH → Na2SnO2 + 2H2O
3. MgCO3 + 2HCl → MgCl2 + CO2 + H2O
4. CaHPO4 + 2HNO3 → H3PO4 + Ca(NO3)2
5. FeS + 2HCl → FeCl2 + H2S
6. Fe2(SO4)3 + 6KI → 3K2SO4 + 2FeCl2 + I2
Bài 5.8 trang 9 sách bài tập Hóa 11
Hoà tan hoàn toàn 0,12 g Mg trong 100,0 ml dung dịch HCl 0,20 M. Tính pH của dung dịch sau khi phản ứng kết thúc (thể tích dung dịch biến đổi không đáng kể).
Lời giải:
Mg + 2HCl → MgCl2 + H2
1 2 (mol)
0,005 0,01 mol
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 1.10−11.10−1M.
Vậy pH = 1.
Bài 5.9 trang 9 sách bài tập Hóa 11
Trong nước biển, magie là kim loại có hàm lượng lớn thứ hai sau natri. Mỗi kilogam nước biển chứa khoảng 1,3 g magie dưới dạng các ion Mg2+. Ở nhiều quốc gia, magie được khai thác từ nước biển. Quá trình sản xuất magie từ nước biển gồm các giai đoạn sau :
1. Nung đá vôi thành vôi sống.
2. Hoà tan vôi sống trong nước biển tạo ra kết tủa Mg(OH)2.
3. Hoà tan kết tủa Mg(OH)2 trong dung dịch HCl.
4. Điện phân MgCl2 nóng chảy:
Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn (nếu có) của quá trình sản xuất trên.
Lời giải:
1. CaCO3 to→ CaO + CO2↑
2. CaO + H2O → Ca(OH)2
Mg2+ + 2OH− → Mg(OH)2
3. Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Mg(OH)2 + 2H+ → Mg2+ + 2H2O
4.
Bài 5.10 trang 9 sách bài tập Hóa 11
Nước chứa nhiểu ion Ca2+ và Mg2+ là nước cứng. Nước chứa ít hoặc không chứa các ion Ca2+ và Mg2+ là nước mềm. Nước cứng không phù hợp cho việc sử dụng trong công nghiệp và sinh hoạt. Trong nước thường chứa các hợp chất Ca(HCO3)2, Mg(HCO3)2, CaCl2 và MgCl2 hoà tan.
Để loại các ion Ca2+ và Mg2+ dưới dạng Ca(HCO3)2, Mg(HCO3)2 và MgCl2 người ta cho sữa vôi Ca(OH)2 vào nước sẽ tạo ra các kết tủa CaCO3 va Mg(OH)2.
Để loại Ca2+ dưới dạng CaCl2 người ta hoà tan Na2CO3 vào nước sẽ tạo kết tủa CaCO3.
Hãy viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng trên.
Lời giải:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Ca2+ + HCO3− + OH− → CaCO3↓ + H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2↓ + 2CaCO3↓ + 2H2O
Mg2+ + 2HCO3− + 2Ca2+ + 4OH− → Mg(OH)2↓ + 2CaCO3↓ + 2H2O
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
Mg2+ + 2OH− → Mg(OH)2↓
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Ca2+ + CO32− → CaCO3↓
Bài 5.11 trang 9 sách bài tập Hóa 11
Có 6 dung dịch đựng trong 6 lọ mất nhãn : Mg(NO3)2, Zn(NO3)2, Pb(NO3)2, AlCl3, KOH và NaCl. Chỉ dùng thêm dung dịch AgNO3 và một thuốc thử nữa, hãy trình bày cách nhận biết từng dung dịch. Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng nhận biết đó.
Lời giải:
Dùng dung dịch phenolphtalein nhận ra dung dịch KOH.
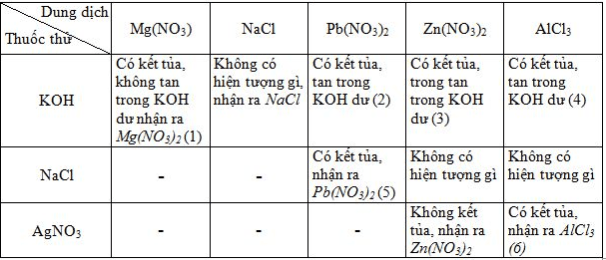
Các phương trình hoá học :
(1) Mg(NO3)2 + 2KOH → Mg(OH)2↓ + 2KNO3
Mg2+ + 2OH− → Mg(OH)2↓
(2) Pb(NO3)2 + 2KOH → Pb(OH)2↓ + 2KNO3
Pb2+ + 2OH− → Pb(OH)2↓
Pb(OH)2 + 2KOH → K2PbO2 + 2H2O
Pb(OH)2 + 2OH− → PbO22− + 2H2O
(3) Zn(NO3)2 + 2KOH → Zn(OH)2↓ + 2KNO3
Zn2+ + 2OH− → Zn(OH)2↓
Zn(OH)2 + 2KOH → K2ZnO2 + 2H2O
Zn(OH)2 + 2OH− → ZnO22− + 2H2O
(4) AlCl3 + 3KOH → Al(OH)3↓ + 3KCl
Al3+ + 3OH− → Al(OH)3↓
Al(OH)3 + KOH → KAlO2 + 2H2O
Al(OH)3 + OH− → AlO2− + 2H2O
(5) 2NaCl + Pb(NO3)2 → 2NaNO3 + PbCl2↓
Pb2+ + 2Cl− → PbCl2↓
(6) 3AgNO3 + AlCl3 → Al(NO3)3 + 3AgCl↓
Ag+ + Cl− → AgCl↓
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 11 Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa Học 11 Bài 45: Axit cacboxylic (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 41: Phenol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 40: Ancol (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 36: Luyện tập: Hiđrocacbon thơm (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 33: Luyện tập: Ankin (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 31: Luyện tập: Anken và ankađien (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 44: Anđehit - Xeton (chính xác nhất)
- Giải SBT Hóa Học 11 Bài 42: Luyện tập: Dẫn xuất halogen, ancol, phenol