Soạn Hóa Lớp 9 Bài 17: Dãy hoạt động hóa học của kim loại đầy đủ nhất
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài tập ứng dụng, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn Lời giải Bài 17: Dãy hoạt động hóa học của kim loại đầy đủ nhất - Hóa 9, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Bài 17: Dãy hoạt động hóa học của kim loại
Bài tập ứng dụng:
Bài 1(Trang 54 SGK Hóa 9):
Dãy kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần?
A. K, Mg, Cu, Al, Zn, Fe.
B. Fe, Cu, K, Mg, Al, Zn.
C. Cu, Fe, Zn, Al, Mg, K.
D. Zn, K, Mg, Cu, Al, Fe.
E. Mg, K, Cu, Al, Fe.
Hướng dẫn giải chi tiết:
Chỉ có dãy C gồm các kim loại: Cu, Fe, Zn, Al, Mg, K được sắp xếp theo chiều hoạt động hóa học tăng dần
Bài 2(Trang 54 SGK Hóa 9):
Dung dịch ZnSO4 có lẫn tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4? Giải thích và viết phương trình phản ứng.
a) Fe.
b) Zn.
c) Cu.
d) Mg.
Hướng dẫn giải chi tiết:
b) Zn. Dùng kẽm vì có phản ứng:
Zn + CuSO4 → ZnSO4 + Cu ↓
Nếu dùng dư Zn, Cu tạo thành không tan được tách ra khỏi dung dịch và thu được dung dịch ZnSO4 tinh khiết.
Bài 3(Trang 54 SGK Hóa 9):
Viết các phương trình hóa học:
a) Điều chế CuSO4 từ Cu.
b) Điều chế MgCl2 từ mỗi chất sau: Mg, MgSO4, MgO, MgCO3 (các hóa chất cần thiết coi như có đủ).
Hướng dẫn giải chi tiết:
a) Sơ đồ chuyển hóa: Cu → CuO → CuSO4
PTHH: 2Cu + O2 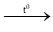
CuO + H2SO4 → CuSO4 + H2O
Hoặc: Cu + 2H2SO4đặc 
b) Cho mỗi chất Mg, MgO, MgCO3 tác dụng với dung dịch HCl, cho MgSO4 tác dụng với BaCl2 ta thu được MgCl2.
Mg + 2HCl → MgCl2 + H2 ↑
MgO + 2HCl → MgCl2 + H2O
MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
MgSO4 + BaCl2 → MgCl2 + BaSO4 ↓.
Bài 4(Trang 54 SGK Hóa 9):
Hãy cho biết hiện tượng nào xảy ra khi cho:
a) Kẽm vào dung dịch đồng clorua.
b) Đồng vào dung dịch bạc nitrat.
c) Kẽm vào dung dịch magie clorua.
d) Nhôm vào dung dịch đồng clorua.
Viết các phương trình phản ứng hóa học nếu có.
Hướng dẫn giải chi tiết:
Hiện tượng xảy ra:
a) Zn tan dần, dung dịch CuCl2 nhạt màu xanh, chất rắn màu đỏ bám vào viên kẽm.
CuCl2 + Zn → ZnCl2 + Cu ↓
b) Cu tan dần, chất rắn màu trắng bám vào bề mặt đồng (Đồng đẩy được Ag ra khỏi dung dịch muối), màu xanh lam dần xuất hiện trong dung dịch.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
c) Không có hiện tượng gì xảy ra và không có phản ứng.
d) Al tan dần, màu xanh lam của dung dịch nhạt dần, có chất rắn màu đỏ bám vào bề mặt nhôm.
2Al + 3CuCl2 → 2AlCl3 + 3Cu ↓
Bài 5(Trang 54 SGK Hóa 9):
Cho 10,5g hỗn hợp hai kim loại Cu, Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc).
a) Viết phương trình hóa học.
b) Tính khối lượng chất rắn còn lại trong dung dịch sau phản ứng.
Lời giải:
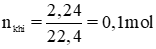
a) Phương trình hóa học của phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2
Cu đứng sau H trong dãy hoạt động hóa học nên không phản ứng với dung dịch H2SO4 loãng
b) Chất rắn còn lại là Cu
Theo pt nZn = nH2 = 0,1 mol ⇒ mZn = 65.0,1 = 6,5g
Khối lượng chất rắn còn lại: mCu = 10,5 – 6,5 = 4g.
Bộ câu hỏi trắc nghiệm:
Câu 1: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn
B. Al, Zn, Na
C. Mg, Al, Na
D. Pb, Al, Mg
Đáp án: A
Câu 2: Từ Cu và hoá chất nào dưới đây để thu được CuSO4 ?
A. MgSO4
B. Al2(SO4)3
C. H2SO4 loãng
D. H2SO4 đặc, nóng
Đáp án: D
Câu 3: Có một mẫu dung dịch MgSO4 bị lẫn tạp chất là ZnSO4, có thể làm sạch mẫu dung dịch này bằng kim loại
A. Zn
B. Mg
C. Fe
D. Cu
Đáp án: B
Giải thích:
Sử dụng một lượng dư kim loại Mg
Mg + ZnSO4 → MgSO4 + Zn ↓
Lọc bỏ kim loại thu được dung dịch MgSO4 tinh khiết.
Câu 4: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al , Zn, Fe
B. Zn, Pb, Au
C. Mg, Fe , Ag
D. Na, Mg , Al
Đáp án: A
Giải thích:
Các kim loại tác dụng được với Cu(NO3)2 tạo thành Cu kim loại phải đứng trước Cu trong dãy hoạt động hóa học của kim loại và các kim loại đó phải không tác dụng với nước.
→ A thỏa mãn.
Câu 5: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng .
Đáp án: A
Giải thích:
Sử dụng một lượng dư dung dịch NaOH
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Lọc lấy kim loại rửa sạch thu được Fe tinh khiết.
Chú ý: Một số kim loại như Al, Zn … có thể tác dụng được với dung dịch kiềm.
Câu 6: Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư , thấy thoát ra 4,48 lít khí hiđro (ở đktc). Vậy kim loại M là :
A. Ca
B. Mg
C. Fe
D. Ba
Đáp án: B
Giải thích:
nkhí = 4,48 : 22,4 = 0,2 mol
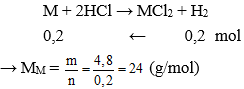
Vậy kim loại cần tìm là Mg.
Câu 7: Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng?
A. Thanh đồng tan dần, khí không màu thoát ra
B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam
C. Không hiện tượng
D. Có kết tủa trắng.
Đáp án: C
Giải thích:
Đồng đứng sau H trong dãy hoạt động hóa học của kim loại nên không tác dụng với H2SO4 loãng.
Câu 8: Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội:
A. Khí mùi hắc thoát ra
B. Khí không màu và không mùi thoát ra
C. Lá nhôm tan dần
D. Không có hiện tượng
Đáp án: D
Giải thích:
Chú ý: Một số kim loại như Al, Fe, Cr … không tác dụng với H2SO4 đặc, nguội.
Câu 9: Cho 5,4 gam nhôm vào dung dịch HCl dư , thể tích khí thoát ra (ở đktc) là:
A. 4,48 lít
B. 6,72 lít
C. 13,44 lít
D. 8,96 lít
Đáp án: B
Giải thích:
Số mol Al = 5,4 : 27 = 0,2 mol
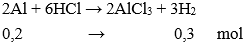
→ Vkhí = 0,3.22,4 = 6,72 lít.
Câu 10: Cho 1 viên Natri vào dung dịch CuSO4, hiện tượng xảy ra:
A. Viên Natri tan dần, sủi bọt khí, dung dịch không đổi màu
B. Viên Natri tan dần,không có khí thoát ra, có kết tủa màu xanh
C. Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh
D. Không có hiện tượng.
Đáp án: C.
Giải thích:
Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh lam
PTHH:
2Na + 2H2O → 2NaOH + H2 ↑
2NaOH + CuSO4 → Cu(OH)2 (↓ xanh) + Na2SO4.
Lý thuyết tổng hợp:
I. Dãy hoạt động hóa học của kim loại được xây dựng như thế nào?
Các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học :
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
II. Dãy hoạt động hóa học của kim loại có ý nghĩa như thế nào?
Dãy hoạt động hóa học của kim loại cho biết:
1. Mức độ hoạt động hóa học của các kim loại giảm dần từ trái sang phải.
2. Những kim loại đứng trước Mg là những kim loại mạnh (K, Na, Ba,..), tác dụng với nước ở điều kiện thường tạo thành kiềm và giải phóng H2.
3. Kim loại đứng trước H phản ứng với một số dung dịch axit giải phóng khí H2.
4. Kim loại đứng trước (trừ Na, K...) đẩy kim loại đứng sau ra khỏi dung dịch muối.
File tải hướng dẫn soạn Hóa 9 Bài 17: Dãy hoạt động hóa học của kim loại:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô tham khảo và đối chiếu đáp án chính xác.
►Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi môn Hóa như đề kiểm tra, hướng dẫn giải sách giáo khoa, vở bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.
- Hóa 9: Bài 23: Báo cáo thực hành tính chất hóa học của nhôm và sắt
- Soạn Hóa Lớp 9 Bài 15: Tính chất vật lý của kim loại đầy đủ nhất
- Soạn Hóa Lớp 9 Bài 17: Dãy hoạt động hóa học của kim loại đầy đủ nhất
- Giải Hoá học 9 Bài 20: Hợp kim sắt: Gang thép trang 63 SGK
- Soạn Hóa học Lớp 9 Bài 16: Tính chất hóa học của kim loại
- Giải Hoá học 9 Bài 22: Luyện tập chương 2: Kim loại trang 69 SGK
- Giải Hoá 9 Bài 19: Sắt SGK trang 60 (chính xác nhât)
- Soạn Hóa học Lớp 9 Bài 18: Nhôm đầy đủ nhất