Soạn Hóa học Lớp 9 Bài 18: Nhôm đầy đủ nhất
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài toán, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn Lời giải Hóa học Lớp 9 Bài 18: Nhôm đầy đủ nhất, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Bài 18: Nhôm
Bài tập:
Bài 1 (Trang 57 SGK Hóa 9):
Hãy điền vào bảng những tính chất tương ứng với những ứng dụng của nhôm:

Hướng dẫn giải chi tiết:

Bài 2 (Trang 58 SGK Hóa 9)
Thả một mảnh nhôm vào các ống nghiệm chứa các dung dịch sau:
a) MgSO4.
b) CuCl2.
c) AgNO3.
d) HCl.
Cho biết hiện tượng xảy ra? Giải thích và viết phương trình hóa học.
Phương pháp giải:
Al chỉ đẩy được các kim loại đứng sau Al trong dãy điện hóa ra khỏi dung dịch muối.
a) không phản ứng
b) Dựa vào màu sắc dung dịch thay đổi và kim loại sinh ra có màu gì => nêu được hiện tượng
c) tương tự b
d) Có khi bay ra hay không? => nêu hiện tượng
Hướng dẫn giải chi tiết:
a) Không có phản ứng, vì hoạt động hóa học của Mg > Al.
b) Al tan dần, màu xanh lam của dung dịch nhạt dần, có chất rắn màu đỏ bám vào bề mặt nhôm.
2Al + 3CuCl2 → 2AlCl3 + 3Cu ↓
c) Al tan dần, có chất rắn màu xám bám ngoài Al.
Al + 3AgNO3 → Al(NO3)3 + 3Ag ↓
d) Có khí hiđro bay lên:
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Bài 3 (Trang 58 SGK Hóa 9):
Có nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng không? Giải thích.
Hướng dẫn giải chi tiết:
Nếu dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi hoặc vữa thì
Các dụng cụ này sẽ bị chóng hư vì trong vôi, nước vôi hoặc vữa đều có chứa Ca(OH)2 là một chất kiềm nên tác dụng được với Al2O3 (vỏ bọc ngoài các đồ dùng bằng nhôm), sau đó đến Al bị ăn mòn.
Phương trình phản ứng:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2 ↑ .
Bài 4 (Trang 58 SGK Hóa 9):
Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm? Giải thích sự lựa chọn.
a) AgNO3.
b) HCl.
c) Mg.
d) Al.
e) Zn.
Phương pháp giải:
Dùng chất nào sau khi phản ứng dung dịch thu được chỉ chứa AlCl3
Hướng dẫn giải chi tiết:
d) Dùng Al để làm sạch muối nhôm vì:
2Al + 3CuCl2 → 2AlCl3 + 3Cu ↓
Bài 5 (Trang 58 SGK Hóa 9):
Thành phần chính của đất sét là Al2O3.2SiO2.2H2O. Hãy tính thành phần phần trăm theo khối lượng của Al có trogn hợp chất trên.
Phương pháp giải:
Tính phân tử khối của đất sét =?
Giả sử có 1 mol đất sét => khối lượng của Al trong đất sét
áp dụng công thức tính thành phần phần trăm:
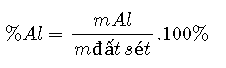
Hướng dẫn giải chi tiết:
M Al2O3.2SiO2.2H2O = 27.2 + 16.3 + 2.(28 + 16.2) + 2.(2 + 16) = 258 (g)
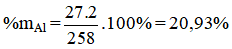
Bài 6 (Trang 58 SGK Hóa 9):
Để xác định phần trăm khối lượng của hỗn hợp A gồm nhôm và magie, người ta thực hiện hai thí nghiệm sau:
– Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 loãng dư, thu được 1568ml khí ở điều kiện tiêu chuẩn.
– Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư thì sau phản ứng thấy còn lại 0,6g chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Phương pháp giải:
Thí nghiệm 1: Cả Al và Mg cùng phản ứng
2Al + 3H2S04 → Al2(S04)3 + 3H2
Mg + H2S04 → MgS04 + H2
Thí nghiệm 2: Chỉ có Al tham gia phản ứng, chất rắn còn lại là Mg dư. => mMg= 0,6 (g)
Dựa vào PTHH (1), (2) và số mol khí H2 tính toán được số mol của Al
=> từ đó tính được phần trăm khối lượng mỗi kim loại trong hỗn hợp.
Hướng dẫn giải chi tiết:
Ở thí nghiệm 2: Al tác dụng hết với NaOH, còn Mg không phản ứng nên khối lượng chất rắn còn lại là Mg, mMg = 0,6g.
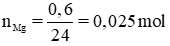
Gọi nAl = x
Phương trình phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑ ( 1)
Mg + H2SO4 → MgSO4 + H2 ↑ (2)
Theo pt (2) nH2 (2) = nMg = 0,025 mol
Theo pt (1) nH2 (1) = 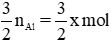
⇒ Tổng số mol H2 là 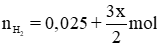 (∗)
(∗)
Theo đề bài ta có: VH2 = 1568ml = 1,568 l
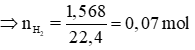
Từ (∗) và (∗∗) ⇒ 0,025 + 3x/2 = 0,07
Giải ra ta có : x = 0,03 mol ⇒ mAl = 0,03 x 27 = 0,81g
mhỗn hợp A = 0,81 + 0,6 = 1,41 g
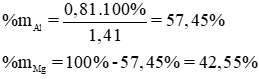
Lý thuyết tổng hợp:
I. TÍNH CHẤT VẬT LÍ
Nhôm là kim loại màu trắng bạc, có ánh kim, dẻo, dẫn điện và dẫn nhiệt tốt. Nhôm là kim loại nhẹ (D = 2,7 g/cm3), mềm, nóng chảy ở 660°c.
II. TÍNH CHẤT HÓA HỌC
1. Nhôm có những tính chất hóa học của kim loại
a) Phản ứng với oxi và một số phi kim
Nhôm phản ứng với oxi tạo thành oxit và phản ứng với nhiều phi kim khác như S, Cl2 tạo thành muối.
Ví dụ:
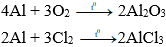
Chú ý: Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
b) Phản ứng với axit (HCl, H2SO4 loãng,…) giải phóng H2.
Ví dụ:
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4 đặc nguội và HNO3 đặc, nguội,
c) Phản ứng với dung dịch muối của kim loại yếu hơn.
Nhôm phản ứng được với nhiều dung dịch muối của những kim loại hoạt động hóa học yếu hơn tạo ra muối nhôm và kim loại mới.
Ví dụ:
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
2. Nhôm có tính chất hóa học nào khác?
Nhôm phản ứng với dung dịch kiềm.
Ví dụ:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
III. ỨNG DỤNG
Nhôm và hợp kim của nhôm được sử dụng rộng rãi trong đời sống: đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng....
Đuyra (hợp kim của nhôm) nhẹ và bền được dùng trong công nghiệp chế tạo máy bay, ô tô, tàu vũ trụ…
IV. SẢN XUẤT NHÔM
Nguyên liệu: quặng bôxit có thành phần chủ yếu là Al2O3.
Phương trình hóa học:
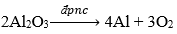
Bài tập trắc nghiệm Hóa 9 Bài 18: Nhôm
Câu 1: Nhôm là kim loại
A. dẫn điện và nhiệt tốt nhất trong số tất cả kim loại.
B. dẫn điện và nhiệt đều kém
C. dẫn điện tốt nhưng dẫn nhiệt kèm.
D. dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Đáp án: D
Câu 2: Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính:
A. dẻo
B. dẫn điện.
C. dẫn nhiệt.
D. ánh kim.
Đáp án: A
Câu 3: Nhôm bền trong không khí là do
A. nhôm nhẹ, có nhiệt độ nóng chảy cao
B. nhôm không tác dụng với nước.
C. nhôm không tác dụng với oxi.
D. có lớp nhôm oxit mỏng bảo vệ.
Đáp án: D
Câu 4: Kim loại nhôm có độ dẫn điện tốt hơn kim loại:
A. Cu, Ag
B. Ag
C. Fe, Cu
D. Fe
Đáp án: D
Câu 5: Thả một mảnh nhôm vào ống nghiệm chứa dung dịch CuSO4. Xảy ra hiện tượng:
A. Không có dấu hiệu phản ứng.
B. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
C. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
D. Có chất khí bay ra, dung dịch không đổi màu
Đáp án: C
Giải thích:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
→ Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
Câu 6: Không được dùng chậu nhôm để chứa nước vôi trong do
A. nhôm tác dụng được với dung dịch axit.
B. nhôm tác dụng được với dung dịch bazơ.
C. nhôm đẩy được kim loại yếu hơn nó ra khỏi dung dịch muối.
D. nhôm là kim loại hoạt động hóa học mạnh
Đáp án: B
Câu 7: Nguyên liệu sản xuất nhôm là quặng:
A. Hematit
B. Manhetit
C. Boxit
D. Pirit.
Đáp án: C
Câu 8: Cặp chất nào dưới đây có phản ứng?
A. Al + HNO3 đặc, nguội
B. Fe + HNO3 đặc, nguội
C. Al + HCl
D. Fe + Al2(SO4)3
Đáp án: C
Giải thích:
2Al + 6HCl → 2AlCl3 + 3H2
A và B sai vì Nhôm không tác dụng với H2SO4 đặc nguội và HNO3 đặc, nguội,
D sai vì Fe đứng sau Al trong dãy hoạt động hóa học của kim loại.
Câu 9: Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4g muối. Kim loại M là:
A. Na
B. Fe
C. Al
D. Mg.
Đáp án: C
Câu 10: Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là :
A. 1,8 g
B. 2,7 g
C. 4,05 g
D. 5,4 g
Đáp án: B
File tải miễn phí hướng dẫn Soạn Hóa học Lớp 9 Bài 18: Nhôm:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô tham khảo, chuẩn bị bài mới tốt nhất.
Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi các môn như đề kiểm tra, hướng dẫn giải sách giáo khoa, vở bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.
- Hóa 9: Bài 23: Báo cáo thực hành tính chất hóa học của nhôm và sắt
- Soạn Hóa Lớp 9 Bài 15: Tính chất vật lý của kim loại đầy đủ nhất
- Soạn Hóa Lớp 9 Bài 17: Dãy hoạt động hóa học của kim loại đầy đủ nhất
- Giải Hoá học 9 Bài 20: Hợp kim sắt: Gang thép trang 63 SGK
- Soạn Hóa học Lớp 9 Bài 16: Tính chất hóa học của kim loại
- Giải Hoá học 9 Bài 22: Luyện tập chương 2: Kim loại trang 69 SGK
- Giải Hoá 9 Bài 19: Sắt SGK trang 60 (chính xác nhât)
- Soạn Hóa học Lớp 9 Bài 18: Nhôm đầy đủ nhất