Soạn Hóa học lớp 9 Bài 32: Luyện tập chương 3 trang 103 (Ngắn gọn)
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài tập ứng dụng, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn Hóa 9 Bài 32: Luyện tập chương 3 trang 103, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
►Tham khảo Bộ câu hỏi Trắc nghiệm Hóa 9 Bài 32:
►Tham khảo một số bài học trước đó:
Giải Hóa 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Soạn Hóa 9 Bài 30: Silic. Công nghiệp Silicat đầy đủ nhất
Giải Hóa 9 Bài 29: Axit cacbonic và muối cacbonat đầy đủ nhất
Bài 32: Luyện tập chương 3
Giải bài tập SGK
Bài 1 (trang 103 Hóa 9):
Căn cứ vào sơ đồ sau:
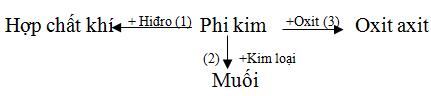
Hãy viết phương trình hóa học với phi kim cụ thể là lưu huỳnh.
Lời giải:
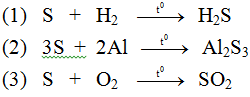
Bài 2 (trang 103 Hóa 9)
Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của clo theo sơ đồ sau:
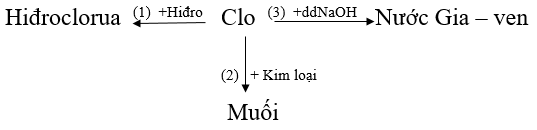
Lời giải:

(4) Cl2(k) + H2O(l) <-> HCl(dd) + HClO(dd)
Bài 3 (trang 103 Hóa 9):
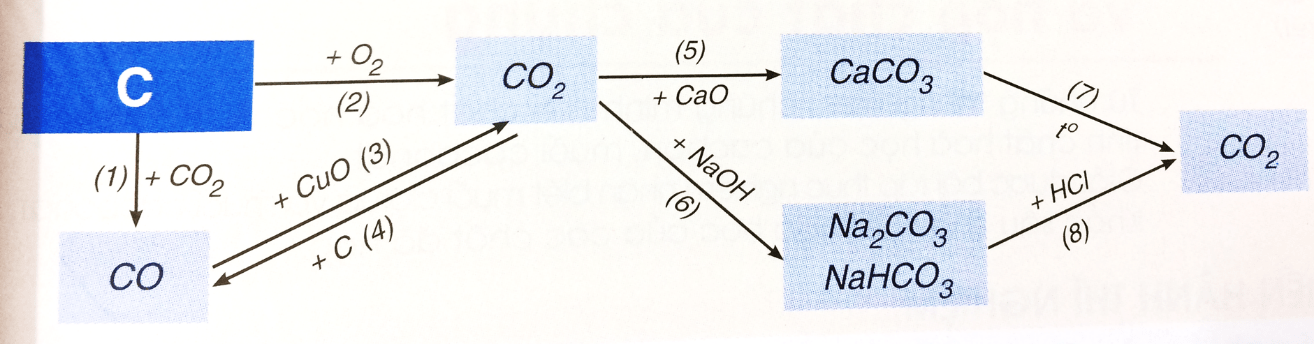
Hãy viết các phương trình hóa học biểu diễn tính chất hóa học của cacbon và một số hợp chất của nó theo sơ đồ 3. Cho biết vai trò của cacbon trong phản ứng đó.
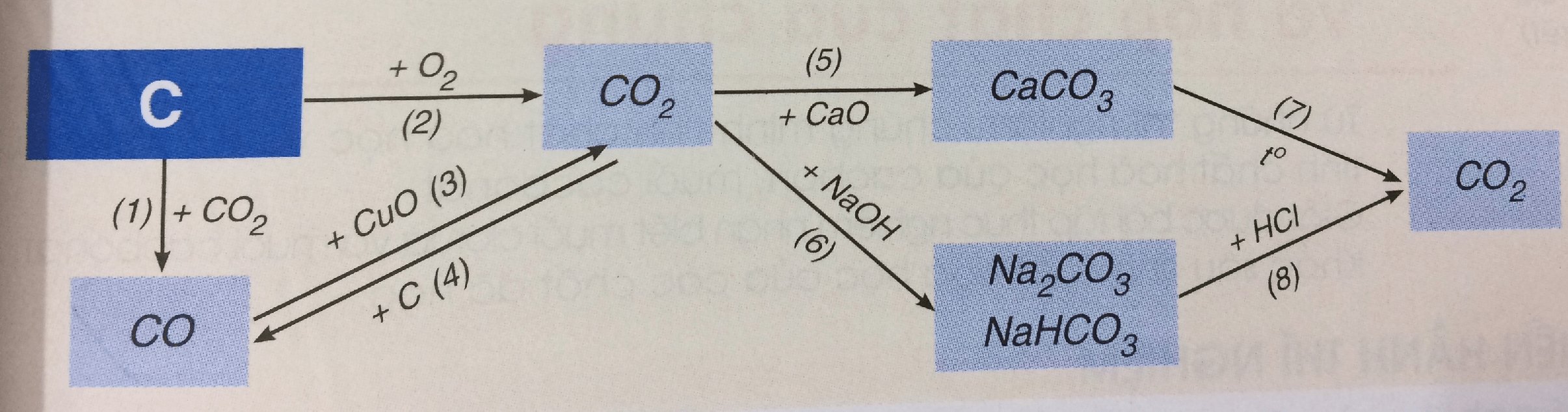
Lời giải:
PTHH biểu diễn tính chất hóa học của cacbon và một số hợp chất khác:
(1) C(r) + CO2 (k) -> (nhiệt độ) 2CO(k)
(2) C(r) + O2 (k) -> (nhiệt độ) CO2
(3) CO + CuO -> (nhiệt độ) Cur + CO2 (k)
(4) CO2 (k) + C(r) -> (nhiệt độ) 2CO(k)
(5) CO2 (k) + CaO(r) -> (nhiệt độ) CaCO3 (r)
(6) CO2(k) + 2NaOH(dd) dư -> Na2CO3 (r) + H2O(l)
CO2 (k) + NaOH (dd) đủ → NaHCO3
(7) CaCO3 (r) -> (nhiệt độ) CaO(r) + CO2 (k)
(8) Na2CO3(r) + 2HCl(dd) → 2NaCl(dd) + CO2(k)↑ + H2O(l)
NaHCO3 (r) + HCl (dd) → NaCl(dd) + CO2(k) + H2O(l)
Vai trò của C trong phản ứng (1), (2) và (4) là chất khử (chất chiếm oxi).
Bài 4 (trang 103 Hóa 9):
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết:
– Cấu tạo nguyên tử của A.
– Tính chất hóa học đặc trưng của A.
– So sánh tính chất hóa học của A với các nguyên tố lân cận.
Lời giải:
a) Cấu tạo nguyên tử của A:
Số hiệu nguyên tử của A là 11 cho biết: natri ở ô số 11, điện tích hạt nhân nguyên tử natri là 11+ có 11 electron trong nguyên tử natri, ở chu kì 3, nhóm I.
b) Tính chất hóa học đặc trưng của natri:
Nguyên tố natri ở đầu chu kì là hai kim loại mạnh, tròn phản ứng hóa học, natri là chất khử mạnh.
Tác dụng với phi kim:
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
Tác dụng với dung dịch axit:
2Na + 2HCl → 2NaCl + H2 ↑
Tác dụng với nước: Nguyên tố Na ngoài tính chất hóa học chung của kim loại còn có tính chất hóa học đặc trưng là tác dụng với H2O ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2 ↑
Tác dụng với dung dịch muối: Na + dung dịch CuSO4
2Na + 2H2O → 2NaOH +H2 ↑
2NaOH + CuSO4 → Cu(OH)2 ↓ +Na2SO4
c) So sánh tính chất hóa học của Na với các nguyên tố lân cận:
Na có tính chất hóa hoc mạnh hơn Mg (nguyên tố sau Na), mạnh hơn Li (nguyên tố trên Na) nhưng yếu hơn K (nguyên tố dưới Na).
Bài 5 (trang 103 Hóa 9):
a) Hãy xác định công thức của một loại oxit sắt, biết rằng khi cho 32g oxit sắt này tác dụng hoàn toàn với khí cacbon oxit thì thu được 22,4g chất rắn.
Biết khối lượng mol của oxit sắt là 160 gam.
b) Chất khí sinh ra được hấp thụ hoàn toàn trong dung dịch nước vôi trong có dư. Tính khối lượng kết tủa thu được.
Lời giải:
a) Gọi công thức của oxit sắt là: FexOy
PTHH:
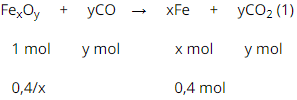
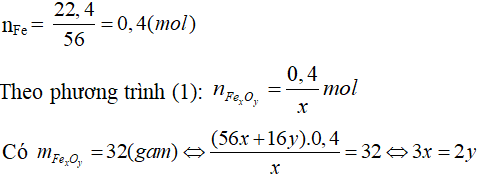
Do đó x : y = 2 : 3.
Vậy CTHH của oxit sắt: Fe2O3.
b) Khí sinh ra CO2
PTHH:
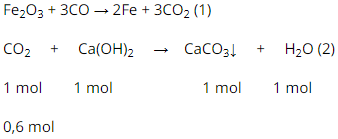
Theo pt (1) : nco2 = 3/2.nFe = 0,4.3/2 = 0,6 (mol)
Theo pt (2) ⇒ nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = 0,6.100 = 60 (g).
Bài 6 (trang 103 Hóa 9):
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Lời giải:
nMnO2 = 69,6/87 = 0,8 mol
VNaOH = 500ml = 0,5 lít ⇒ nNaOH = CM. V= 0,5 x 4 = 2 mol.
Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Theo pt: nCl2 = nMnO2 = 0,8 mol.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Ta có tỉ lệ: 0,8/1 < 2/2→ NaOH dư nên tính nNaCl và nNaClO theo nCl2
Theo pt: nNaCl = nNaClO = nCl2 = 0,8 mol.
CM(NaCl)= CM(NaClO) = 0,8/0,5 = 1,6 mol/l.
Theo pt: nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6mol.
CM(NaOH) dư = (2 - 1,6)/0,5 = 0,8 mol/l.
Lý thuyết trọng tâm
1. Tính chất hóa học của phi kim
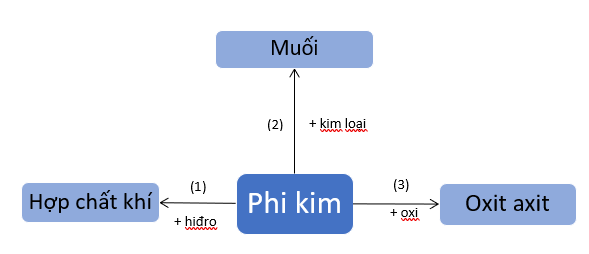
2. Tính chất hóa học của 1 số phi kim cụ thể
a) Tính chất hóa học của clo
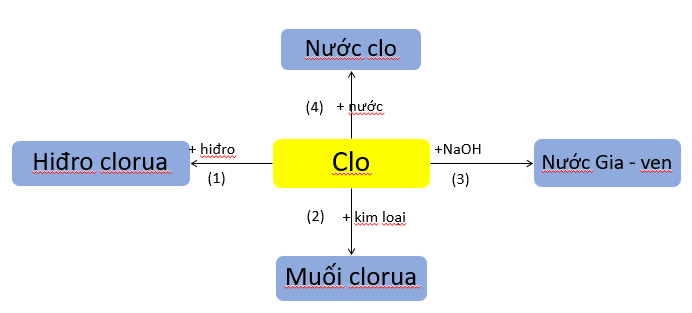
b) Tính chất hóa học các hợp chất của cacbon
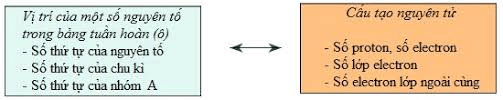
3. Bảng tuần hoàn các nguyên tố hóa học
a) Cấu tạo của bảng tuần hoàn
- Ô nguyên tố
- Chu kỳ
- Nhóm
b) Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
+) Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
+) Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
+) Số lớp electron của nguyên tử tăng dần.
+) Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
c) Ý nghĩa bảng tuần hoàn
Biết vị trí của nguyên tố trong bảng tuần hoàn ta có thể suy đoán cấu tạo nguyên tử và ngược lại.
>> Bài học tiếp theo:
►File tải miễn phí:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô giáo tham khảo và đối chiếu đáp án chính xác.
►Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi môn toán khác được cập nhật liên tục tại chuyên trang của chúng tôi.
- Soạn Hóa 9 Bài 29: Axit cacbonic và muối cacbonat đầy đủ nhất
- Soạn Hóa 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Soạn Hóa học lớp 9 Bài 32: Luyện tập chương 3 trang 103 (Ngắn gọn)
- Giải Hóa 9 Bài 30: Silic. Công nghiệp Silicat đầy đủ nhất
- Giải bài tập Hóa 9 Bài 27: Cacbon chi tiết nhất
- Giải Hóa học lớp 9 Bài 25: Tính chất của phi kim đầy đủ nhất
- Giải bài tập Hóa 9 Bài 28: Các oxit của cacbon chi tiết nhất
- Giải bài tập Hóa 9 Bài 26: Clo chi tiết nhất