Giải Hoá học 11 Bài 10: Photpho trang 49, 50 SGK
Giải Hoá học 11 Bài 10: Photpho trang 49, 50 SGK giúp các em ôn tập sâu kiến thức thông qua hướng dẫn giải bài tập trong sách giáo khoa bằng các phương pháp giải hay, ngắn gọn. Hỗ trợ các em học tập tốt môn Hoá lớp 11.
Giải bài tập SGK Hóa 11 Bài 10
Giải bài 1 trang 49 SGK Hóa 11
Nêu những điểm khác nhau về tính chất vật lí của P trắng và P đỏ. Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại?
Lời giải:
- Những điểm khác nhau về tính chất vật lí:

Giải bài 2 SGK Hóa 11 trang 49
Lập phương trình hoá học của các phản ứng sau đây và cho biết trong các phản ứng này, P có tính khử hay tính oxi hoá?
a. P + O2 → P2O5
b. P + Cl2 → PCl3
c. P + S → P2S3
d. P + S → P2S5
e. P + Mg → Mg3P2
f. P + KClO3 → P2O5 + KCl
Lời giải:
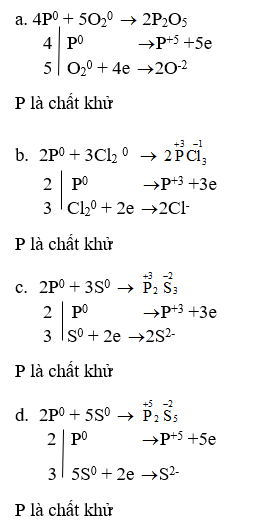
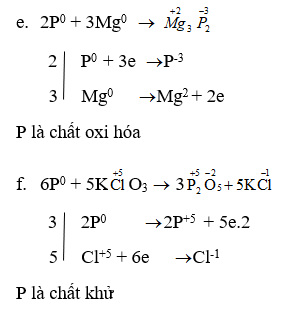
Giải bài 3 SGK trang 49 Hóa 11
Thí nghiệm ở hình 2.13(SGK) chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hoá học của phản ứng xảy ra?
Lời giải:
P đỏ được đặt trên thanh sắt gần ngọn lửa hơn P trắng (to cao hơn). Hiện tượng: P trắng bốc cháy còn P đỏ thì không. Chứng tỏ P trắng dễ phản ứng với oxi hơn P đỏ rất nhiều. Thực tế P trắng có thể bị oxi hoá trong không khí ở nhiệt độ thường (hiện tượng phát quang hoá học), còn P đỏ thì bốc cháy khi đun nóng ở nhiệt độ 250oC.
4P +5O2 → 2P2O5
Giải bài 4 trang 50 Hóa 11 SGK
Nêu những ứng dụng của photpho. Những ứng dụng đó xuất phát từ tính chất gì của photpho?
Lời giải:
- Ứng dụng:
+ P đỏ được dùng trong sản xuất diêm.
+ Điều chế axit photphoric, thuốc trừ sâu chứa photpho…
+ Dùng trong quân sự: sản xuất bom, đạn cháy, đạn khói…
+ Photpo còn là một nguyên tố rất cần cho con người nhất là trí thông minh, sáng tạo, phát triển xương. Cần cho cây nhất là cấy ăn quả.
- Những ứng dụng đó xuất phát từ tính khử và tính oxi hoá của photpho.
Giải bài 5 Hóa 11 SGK trang 50
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a. Viết phương trình hoá học của các phản ứng xảy ra?
b. Tính khối lượng dung dịch NaOH đã dùng?
c. Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Lời giải:
a. Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b.
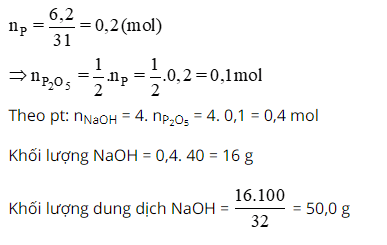

Lý thuyết Hóa 11 Bài 10: Photpho
I. Tính chất vật lí
a. P trắng
- Dạng tinh thể do phân tử P4.
- Không màu hoặc vàng nhạt giống như sáp.
- Dễ nóng chảy bay hơi, tº = 44,1ºC.
- Rất độc, gây bỏng nặng khi rơi vào da.
- Không tan trong nước nhưng tan trong dung môi hữu cơ: C6H6, ete...
- Oxi hoá chậm ⇒ phát sáng.
- Kém bền tự cháy trong không khí ở điều kiện thường.
b. P đỏ
- Dạng Polime.
- Chất bột màu đỏ.
- Khó nóng chảy, khó bay hơi, tºn/c = 250ºC.
- Không độc.
- Không tan trong bất kỳ dung môi nào.
- Không độc.
- Không oxi hoá chậm ⇒ không phát sáng.
- Bền trong không khí ở điều kiện thường, bền hơn P trắng.
- Khi đun nóng không có không khí P đỏ ⇒ P trắng.
Vì P có các số oxi hoá: -3, 0, +3, +5. Có thể thể hiện tính khử và tính oxi hoá.
II. Tính chất hóa học
- Độ âm điện P < N.
- Nhưng P hoạt động hóa học hơn N2 vì liên kết N ≡ N bền vững.
- P trắng hoạt động hơn P đỏ.
a. Tính oxi hoá: tác dụng với một số kim loại hoạt động, tạo ra photphua kim loại.
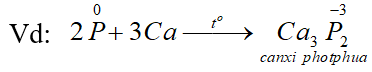
b. Tính khử: tác dụng với các phi kim hoạt động như oxi, halozen, lưu huỳnh … cũng như với các chất oxi hóa mạnh khác
- Tác dụng với oxi: Khi đốt nóng, photpho cháy trong không khí tạo ra các oxit của photpho:
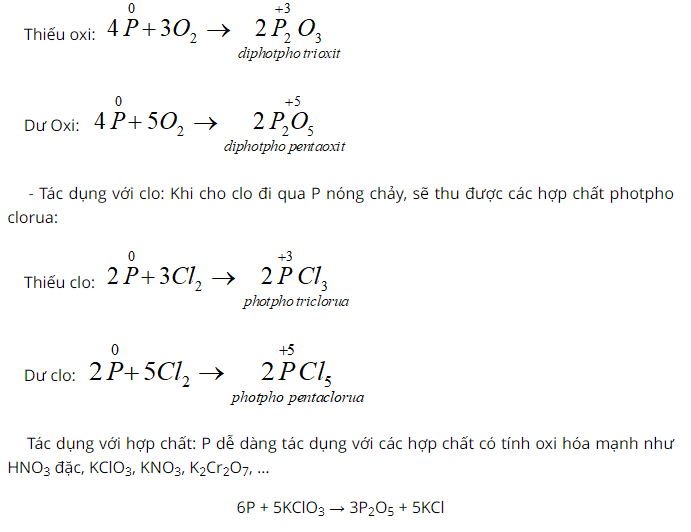
III. Trạng thái tự nhiên
- P khá hoạt động về mặt hóa học nên không gặp P ở dạng tự do trong tự nhiên.
- Phần lớn P tồn tại ở dạng muối của axit photphoric. Hai khoáng vật chính của photpho là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Sản xuất axit photphoric, sản xuất diêm.
- Ngoài ra được sử dụng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói, ....
2. Điều chế
Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc khoảng 1200ºC trong lò điện:
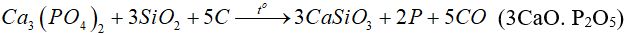
Hơi photpho thoát ra được ngưng tụ khi làm lạnh, thu được photpho trắng ở dạng rắn.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hoá học 11 Bài 10: Photpho trang 49, 50 SGK file PDF hoàn toàn miễn phí!
- Thực hành 2 Hóa Lớp 11: Tính chất của một số hợp chất Nitơ, Photpho
- Soạn Hóa học Lớp 11 Bài 12: Phân bón hóa học chi tiết nhất
- Giải Hoá học 11 Bài 11: Axit photphoric và muối photphat trang 53, 54 SGK
- Giải Hoá học 11 Bài 13: Luyện tập trang 61, 62 SGK
- Giải Hoá học 11 Bài 10: Photpho trang 49, 50 SGK
- Giải Hoá học 11 Bài 9: Axit nitric và muối nitrat trang 45 SGK
- Giải Hoá học 11 Bài 8: Amoniac và muối amoni trang 37, 38 SGK
- Giải Hoá học 11 Bài 7: Nitơ trang 31 SGK