Giải Hoá học 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit - bazơ trang 14 SGK
Giải Hoá học 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ trang 14 SGK giúp các em ôn tập sâu kiến thức thông qua hướng dẫn giải bài tập trong sách giáo khoa bằng các phương pháp giải hay, ngắn gọn. Hỗ trợ các em học tập tốt môn Hoá lớp 11.
Giải bài tập SGK Hóa 11 Bài 3
Giải bài 1 trang 14 SGK Hóa 11
Tích số ion của nước là gì và bằng bao nhiêu ở 25oC?
Lời giải:
Tích số ion của nước là tích số của nồng độ H+ và nồng độ OH- ([H+][OH- ] ) trong nước và cả trong các dung dịch loãng của các chất khác nhau. Ở 25oC bằng thực nghiệm, người ta xác định được [H+] = [OH-] = 10-7 (M).
Vậy tích số ion của nước (ở 25oC) là [H+][OH-] = 10-14.
Giải bài 2 SGK Hóa 11 trang 14
Phát biểu định nghĩa môi trường axit, trung tính và kiềm theo nồng độ H+ và pH?
Lời giải:
- Môi trường axit là môi trường trong đó [H+] > [OH-] hay [H+] > 10-7 M hoặc pH < 7.
- Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10-7 M hoặc pH = 7.
- Môi trường kiềm là môi trường trong đó [H+] < [OH-] hay [H+] < 10-7 MM hoặc pH > 7.
Giải bài 3 SGK trang 14 Hóa 11
Chất chỉ thị axit – bazơ là gì? Hãy cho biết màu của quỳ tím và phenolphtalein trong các khoảng pH khác nhau?
Lời giải:
Chất chỉ thị axit –bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Màu của quỳ tím trong các khoảng pH khác nhau:
| pH | pH ≤ 6 | 6 < pH < 8 | pH ≥ 8 |
| Quỳ | Đỏ | Tím | Xanh |
Màu của phenolphtalien trong các khoảng pH khác nhau:
| pH | pH < 8,3 | 8,3 ≤ pH ≤ 10 |
| Phenolphtalien | Không màu | Hồng |
Giải bài 4 trang 14 Hóa 11 SGK
Một dung dịch có [OH- ]= 1,5.10-5. Môi trường của dung dịch này là:
A. Axit ; C. Kiềm
B. Trung tính ; D. Không xác định được
Lời giải:
- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
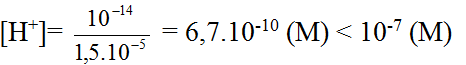
Vậy môi trường của dung dịch là kiềm.
Giải bài 5 Hóa 11 SGKtrang 14
Tính nồng độ H+, OH- và pH của dung dịch HCl 0,10M và dung dịch NaOH 0,010M?
Lời giải:

Giải bài 6 Hóa lớp 11 SGK trang 14
Dung dịch HCl 0,010M, tích số ion của nước là:
A. [H+][OH- ] > 1,0.10-14 ;
B. [H+ ][OH- ] = 1,0.10-14
C. [H+][OH- ] < 1,0.10-14 ;
D. Không xác định được
Lời giải:
- Đáp án B.
- Vì tích số ion của nước là hằng số trong nước và cả trong các dung dịch loãng của các chất khác nhau.
Lý thuyết Hóa 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
I. Nước là chất điện li yếu
1. Sự điện li của nước
- Nước là chất điện li rất yếu.
- Phương trình điện li:
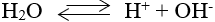
2. Tích số ion của nước
- Ở 25oC, hằng số KH2O gọi là tích số ion của nước:
KH2O = [H+].[OH-] = 10-14
⇒ [H+] = [OH-] = 10-7.
- Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10-7 M.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
Là môi trường trong đó [H+] > [OH-] hay [H+] > 10-7 M.
b. Môi trường kiềm
Là môi trường trong đó [H+] < [OH-] hay [H+] < 10-7 M.
II. Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH

2. Chất chỉ thị axit – bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tím, phenolphatalenin.
Bảng màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
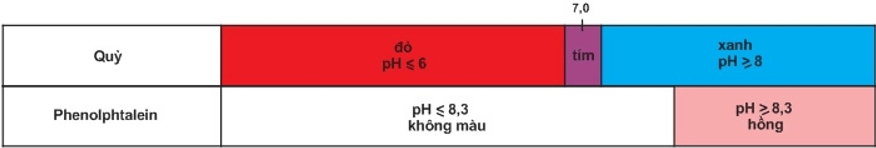
Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng. Dùng băng giấy tẩm dung dịch hỗn hợp này có thể xác định được gần đúng giá trị pH của dung dịch.
3. Bảng công thức pH trong các môi trường
| CÔNG THỨC | MÔI TRƯỜNG |
| pH = - lg[H+] pOH = - lg[OH-] [H+].[OH-] = 10-14 pH + pOH = 14 pH = a [H+] = 10-a pOH = b [OH-] = 10-b | pH < 7 → Môi trường axít pH > 7 → Môi trường bazơ pH = 7 → Môi trường trung tính [H+] càng lớn ↔ Giá trị pH càng bé [OH-] càng lớn ↔ Giá trị pH càng lớn |
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hoá học 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ trang 14 SGK file PDF hoàn toàn miễn phí!
- Giải Hoá học 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li trang 20 SGK
- Giải Hoá học 11 Bài 6: Bài thực hành 1 trang 24 SGK
- Giải Hoá học 11 Bài 5: Luyện tập trang 22, 23 SGK
- Giải Hoá học 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit - bazơ trang 14 SGK
- Giải Hoá học 11 Bài 2: Axit, bazơ và muối trang 10 SGK
- Giải Hoá học 11 Bài 1: Sự điện li trang 7 SGK