Giải Hoá học 11 Bài 17: Silic và hợp chất của silic trang 79 SGK
Giải Hoá học 11 Bài 17: Silic và hợp chất của silic trang 79 SGK giúp các em ôn tập sâu kiến thức thông qua hướng dẫn giải bài tập trong sách giáo khoa bằng các phương pháp giải hay, ngắn gọn. Hỗ trợ các em học tập tốt môn Hoá lớp 11.
Giải bài tập SGK Hóa 11 Bài 17
Giải bài 1 trang 79 SGK Hóa 11
Nêu những tính chất hóa học giống và khác nhau giữa silic và cacbon. Viết các phương trình hóa học để minh họa ?
Lời giải:
Tính chất giống nhau
- Đều có tính oxi hoá
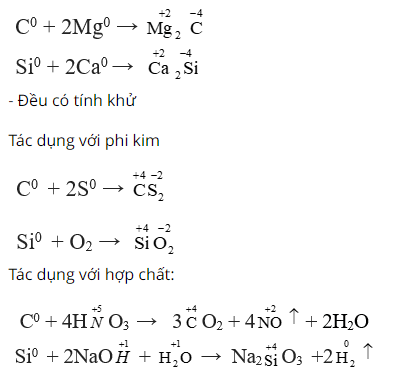
Giải bài 2 SGK Hóa 11 trang 79
Số oxi hóa cao nhất của silic thể hiện ở hợp chất nào sau đây?
A. SiO
B. SiO2
C. SiH4
D. Mg2Si
Lời giải:
Đáp án B
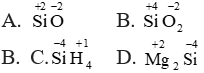
Giải bài 3 SGK trang 79 Hóa 11
Khi cho nước tác dụng với oxit axit thì axit sẽ không được tạo thành, nếu oxit axit đó là:
A. Cacon đioxit
B. Lưu huỳnh đioxit
C. Silic đioxit
D. Đinitơ pentaoxit
Lời giải:
Đáp án C.
Vì SiO2 là chất rắn không tan trong nước.
Giải bài 4 trang 79 Hóa 11 SGK
Từ SiO2 và các hóa chất cần thiết khác, hãy viết phương trình hóa học của các phản ứng điều chế axit silixic?
Lời giải:
Sơ đồ: SiO2 → Na2SiO3 → H2SiO3
Phương trình phản ứng:
SiO2 + 2NaOH → Na2SiO3 + H2O
Na2SiO3 + 2HCl → 2NaCl + H2SiO3 ↓
Giải bài 5 Hóa 11 SGK trang 79
Phương trình ion rút gọn: 2H+ + SiO32- → H2SiO3 ↓ ứng với phản ứng nào giữa các chất nào sau đây?
A. Axit cacbonic và canxi silicat
B. Axit cacbonic và natri silicat
C. Axit clohiđrit và canxi silicat
D. Axit clohiđrit và natri silicat
Lời giải:
Đáp án D
A. H2CO3 là axit yếu + CaSiO3 ↓ không có phản ứng
B. H2CO3 là axit yếu + NaSiO3 không có phản ứng
C. HCl + CaSiO3 ↓ (không phân li ra SiO32-)
D. Pt ion: 2H+ + 2Cl- + 2Na+ + SiO32- → H2SiO3 ↓ + 2Na+ + 2Cl-
Pt ion rút gọn 2H+ + SiO32- → H2SiO3 ↓
Giải bài 6 Hóa lớp 11 SGK trang 79
Cho hỗn hợp silic và than có khối lượng 20,0g tác dụng với lượng dư dung dịch NaOH đặc, đun nóng. Phản ứng giải phóng ra 13,44 lít khí hidro (đktc)Xác định thành phần phần trăm khối lượng của silic trong hỗn hợp ban đầu, biết rằng phản ứng xảy ra với hiệu suất 100%.
Lời giải:
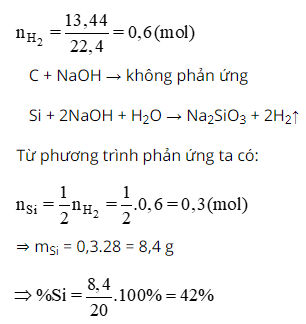
Lý thuyết Hóa 11 Bài 17: Silic và hợp chất của silic
I. Tính chất vật lý
- Silic có hai dạng thù hình: silic tinh thể và silic vô định hình.
II. Tính chất hóa học
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
a. Tính khử
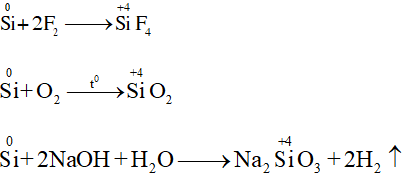
b. Tính oxi hóa
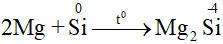
III. Trạng thái tự nhiên
- Silic là nguyên tố phổ biến thứ hai sau oxi, chiếm gần 29,5% khối lượng vỏ Trái Đất.
- Trong tự nhiên chỉ gặp silic dưới dạng các hợp chất, chủ yếu là cát (SiO2), các khoáng vật silicat và aluminosilicat như: cao lanh (Al2O3.2SiO2.2H2O), xecpentin (3MgO.2SiO2.2H2O), ...
- Silic còn có trong cơ thể động vật, thực vật với lượng nhỏ và có vai trò đáng kể trong hoạt động của thế giới hữu sinh.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Silic siêu tinh khiết là chất bán dẫn được dùng trong kĩ thuật vô tuyến và điện tử. Pin mặt trời chế tạo từ silic có khả năng chuyển năng lượng mặt trời thành điện năng, cung cấp cho các thiết bị trên tàu vũ trụ.
- Trong luyện kim, hợp kim ferosilic được dùng để chế tạo thép chịu axit.
2. Điều chế
- Khử SiO2 ở nhiệt độ cao.
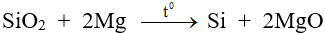
B. Hợp chất của Silic
I. Silic đioxit
- SiO2 là chất ở dạng tinh thể.
- Tan chậm trong dung dịch kiềm đặc nóng, tan dễ trong kiềm nóng chảy.
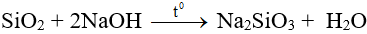
- Tan được trong axit HF.
SiO2 + 4HF → SiF4 + 2H2O
- Dựa vào tính chất này, người ta dùng dung dịch HF để khắc chữ lên thủy tinh.
II. Axit silixic
- H2SiO3 là chất ở dạng keo, không tan trong nước. Khi mất một phần nước tạo thành vật liệu xốp là silicagen. Dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
- Axit silixic là axit yếu, yếu hơn cả axit cacbinic nên bị axit này đẩy ra khỏi dung dịch muối.
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
III. Muối silicat
- Đa số các muối silicat đều không tan, chỉ có muối silicat của kim loại kiềm tan được trong nước.
- Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hoá học 11 Bài 17: Silic và hợp chất của silic trang 79 SGK file PDF hoàn toàn miễn phí!