Soạn Hóa học Lớp 11 Bài 15: Cacbon đầy đủ nhất
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài toán, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn Lời giải Hóa học 11 Bài 15: Cacbon đầy đủ nhất, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Bài 15: Cacbon
Bài tập:
Bài 1 (trang 70 SGK Hóa 11):
Tại sao hầu hết các hợp chất của cacbon lại là hợp chất cộng hóa trị ?
Hướng dẫn giải chi tiết:
Cấu hình e của C: 1s22s22p2
C có 4e lớp ngoài, để bền vững các nguyên tố cần có 8e lớp ngoài cùng. Độ âm điện của C là 2,55 ( độ âm điện trung bình) nên C khó cho hoặc nhận e một cách hoàn toàn vì vậy mà chủ yếu C hình thành liên kết với các nguyên tố khác bằng việc dùng chung các e (liên kết cộng hoá trị).
Bài 2 (trang 70 SGK Hóa 11):
Tính oxi hóa của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
A. C + O2 → CO2
B. C + 2CuO → 2Cu + CO2
C. 3C + 4 Al → Al4C3
D. C + H2O → CO + H2
Hướng dẫn giải chi tiết:
- Đáp án C.
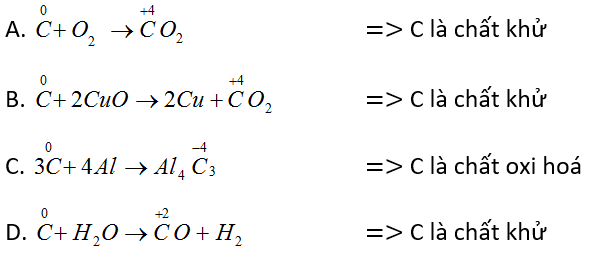
C thể hiện tính oxi hoá khi số oxi hoá giảm (tác dụng với chất khử) nên đáp án C đúng.
Bài 3 (trang 70 SGK Hóa 11):
Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
A. 2C + Ca → CaC2
B. C + 2H2 → CH4
C. C + CO2 → 2CO
D. 3C + 4Al → Al4C3
Hướng dẫn giải chi tiết:
- Đáp án C.
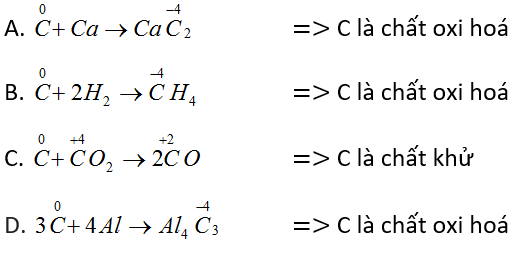
C thể hiện tính khử khi số oxi hoá tăng (tác dụng với chất oxi hoá) nên đáp án C đúng.
Bài 4 (trang 70 SGK Hóa 11):
Lập phương trình hóa học của các phản ứng sau đây:
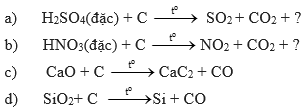
Hướng dẫn giải chi tiết:
Lời giải dưới thể hiện đầy đủ cả phần tăng giảm số oxi-hóa và cách cân bằng pthh:
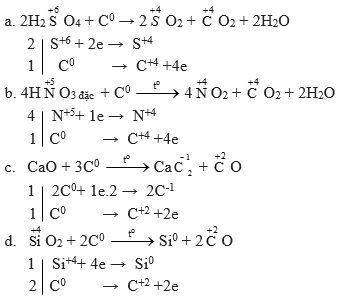
Bài 5 (trang 70 SGK Hóa 11):
Đốt một mẫu than đá (chứa tạp chất không cháy) có khối lượng 0,600kg trong oxi dư, thu được 1,06 m3 (đktc) khí cacbonic. Tính thành phần phần trăm khối lượng của cacbon trong mẫu than đá trên.
Hướng dẫn giải chi tiết:
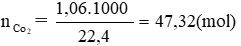
C + O2 → CO2
47,32 ← 47,32 (mol)
Theo pt: nC = nCO2 = 47,32 mol ⇒ mC = 47,32. 12 = 567,84 g
% khối lượng của C là:
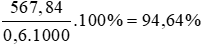
Lý thuyết tổng hợp:
I. Vị trí cấu tạo và tính chất vật lý
1. Vị trí - Cấu hình electron nguyên tử
- Cacbon ở ô thứ 6, chu kỳ 2, nhóm IVA của bảng tuần hoàn.
- Cấu hình e: 1s22s22p2. C có 4 electron lớp ngoài cùng.
- Các số oxi hóa của C là: -4, 0, +2, +4.
2. Tính chất vật lý
- C có ba dạng thù hình chính: Kim cương, than chì và fuleren.
- Kim cương là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. Kim cương có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất.
- Than chì là tinh thể màu xám đen, có ánh kim, dẫn điện tốt nhưng kém kim loại. Tinh thể than chì có cấu trúc lớp.
II. Tính chất hóa học
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
a. Tính khử
- Tác dụng với oxi
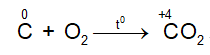
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
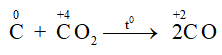
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
b. Tính oxi hóa
- Tác dụng với hidro
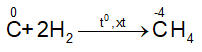
- Tác dụng với kim loại
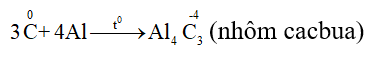
III. Trạng thái tự nhiên
- Kim cương và than chì là cacbon ở dạng tự do gần như tinh khiết.
- Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3). Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon. Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài.
- Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.
- Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.
- Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp phụ.
- Than muội được dùng làm chất độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày.
2. Điều chế
- Kim cương nhân tạo được điều chế bằng cách nung than chì ở 2000oC, p từ 50 - 100 nghìn atm, xúc tác là Fe, Cr, Ni.
- Than chì nhân tạo được điều chế bằng cách nung than cốc ở 2500 - 3000oC trong lò điện, không có không khí.
- Than cốc được điều chế bằng cách nung than mỡ khoảng 1000oC trong lò cốc, không có không khí.
- Than gỗ được tạo nên khi đốt cháy gỗ trong điều kiện thiếu không khí.
- Than muội được tạo nên khi nhiệt phân metan ở điều kiện nhiệt độ và xúc tác thích hợp.
- Than mỏ được khai thác trực tiếp từ các vỉa than nằm sâu dưới mặt đất.
File tải miễn phí Bài soạn Hóa học Lớp 11 Bài 15: Cacbon:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô tham khảo, chuẩn bị tốt cho bài học mới.
Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện các môn như đề kiểm tra, hướng dẫn giải sách giáo khoa, vở bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.