Soạn Hóa học Lớp 11 Bài 19: Luyện tập trang 86 đầy đủ nhất
Để quá trình tiếp thu kiến thức mới trở nên dễ dàng và đạt hiệu quả nhất, trước khi bắt đầu bài học mới các em cần có sự chuẩn bị nhất định qua việc tổng hợp nội dung kiến thức lý thuyết trọng tâm, sử dụng những kiến thức hiện có thử áp dụng giải các bài hóa, trả lời câu hỏi liên quan. Dưới đây chúng tôi đã soạn sẵn Lời giải Bài 19: Luyện tập - Tính chất hóa học của cacbon, silic và các hợp chất của chúng Hóa học Lớp 11 trang 86, giúp các em tiết kiệm thời gian. Nội dung chi tiết được chia sẻ dưới đây.
Bài 19: Luyện tập - Tính chất hóa học của cacbon, silic và các hợp chất của chúng
Bài tập:
Bài 1 (trang 86 SGK Hóa 11):
Nêu các điểm giống và khác nhau về tính chất giữa cacbon đioxit và silic đioxit ?
Phương pháp giải:
- Giống nhau: đều là oxit axit
Lấy ví dụ cả 2 chất đều tác dụng được với NaOH
- Khác nhau: Kẻ bảng so sánh sự khác nhau về tính chất vật lí và tính chất hóa học
Lấy ví dụ minh họa
Hướng dẫn giải chi tiết:
- Giống nhau: đều là oxit axit
CO2 + 2NaOH → Na2CO3 + H2O
SiO2 tan chậm trong kiềm đặc nóng, tan dễ trong kiềm nóng chảy:
SiO2 + 2NaOHn,c → Na2SiO3 + H2O
- Khác nhau:
Cabon đioxit (CO2)
- Ở thể khí trong điều kiện thường
- Tan trong nước tạo môi trường axit yếu
- Không tác dụng với HF
- Tác dụng với dung dịch kiềm ở điều kiện thường
Silic đioxit (SiO2)
- Ở thể rắn trong điều kiện thường
- Không tan trong nước
- Tác dụng được với HF
- Tác dụng với kiềm nóng chảy
Bài 2 (trang 86 SGK Hóa 11):
Phản ứng hóa học không xảy ra ở những cặp chất nào sau đây ?
A. C và CO
B. CO2 và NaOH
C. K2CO3 và SiO2
D. H2CO3 và Na2SiO3
E. CO và CaO
G. CO2 và Mg
H. SiO2 và HCl
I. Si và NaOH
Phương pháp giải:
Phản ứng hóa học không xảy ra khi cả 2 chất đều có tính hóa học tương tự nhau;hoặc phản ứng không sinh ra chất kết tủa, chất bay hơi
Ví du: cùng có tính khử, cùng có tính oxi hóa mạnh sẽ không phản ứng được với nhau
Hướng dẫn giải chi tiết:
→Đáp án A, C, E, H
Phương trình hóa học của những có tham gia phản ứng:
B. CO2 + 2NaOH → Na2CO3 + H2O (Hoặc CO2 + NaOH → NaHCO3)
D. H2CO3 + Na2SiO3 → Na2CO3 + H2SiO3 ↓
G. 2Mg + CO2 → C + 2MgO
I. Si + 2NaOH + H2O → Na2SiO3 + 2H2
Bài 3 (trang 86 SGK Hóa 11):
Có các chất sau: CO2, Na2CO3, C, NaOH, Na2SiO3, H2SiO3. Hãy lập thành một dãy chuyển hóa giữa các chất và viết phương trình hóa học.
Phương pháp giải:
Hướng dẫn giải chi tiết:
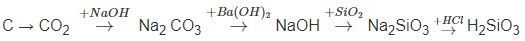
1. C + O2 -to→ CO2
2. CO2 + 2NaOH → Na2CO3 + H2O
3. Na2CO3 + Ba(OH)2 → BaCO3 ↓ + 2NaOH
4. SiO2 + 2NaOHđặc, nóng → Na2SiO3 + H2O
5. Na2SiO3 + 2HCl → 2NaCl + H2SiO3
→Còn tiếp:........................
►Các em và thầy cô tải trọn bộ hướng dẫn giải chi tiết các bài tập Hóa 11 Bài 19: Luyện tập tại đường link cuối bài!...
Lý thuyết tổng hợp:
I. Cacbon
1. Đơn chất
- Chất rắn, không tan trong nước, có 4 dạng thù hình: Kim cương, than chì, Fuleren, than vô định hình.
- Tính khử:
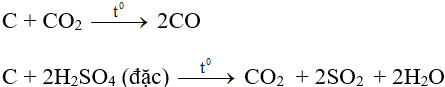
- Tính oxi hóa:
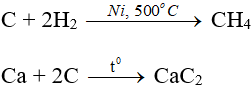
2. Oxit
a. Cacbon monooxit (CO)
- CO là oxit trung tính. Không màu, không mùi, nhẹ hơn không khí, ít tan trong nước, rất độc.
- Hoá tính quan trọng là tính khử ở nhiệt độ cao:
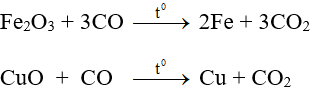
b. Cacbon đioxit (CO2)
- Khí không màu, không mùi, nặng hơn không khí, dễ hóa lỏng, không duy trì sự cháy và sự sống. Ở trạng thái rắn, CO2 gọi là nước đá khô.
- CO2 là một oxit axit.
CO2 + H2O → H2CO3
CO2 + NaOH → NaHCO3
- Tính oxi hóa:
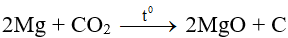
3. Axit cacbonic
- Là axit rất yếu và kém bền.
H2CO3 → CO2↑ + H2O
- Trong nước, điện li yếu:
H2CO3 → HCO3- + H+
HCO3- → CO32- + H+
4. Muối cacbonat
- Tính tan: Muối axit đa số dễ tan (trừ NaHCO3 hơi ít tan). Muối trung hoà không tan trong nước (trừ cacbonat của kim loại kiềm và amoni).
- Tác dụng với axit:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
- Tác dụng với dung dịch kiềm:
NaHCO3 + NaOH → Na2CO3 + H2O
- Thủy phân trong nước tạo môi trường kiềm:
CO32- + H2O → HCO3- + OH-
HCO3- + H2O → H2CO3 + OH-
- Dễ bị nhiệt phân hủy:
2NaHCO3 → Na2CO3 + CO2 + H2O
CaCO3 → CaO + CO2
II. Silic
1. Đơn chất
- Silic là chất rắn có 2 dạng thù hình: Si vô định hình, Si tinh thể.
- Si là phi kim yếu, tương đối trơ.
- Tính khử:
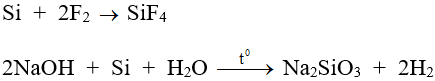
- Tính oxi hóa:
.png)
2. Silic đioxit (SiO2)
- Dạng tinh thể, không tan trong nước, nhiệt độ nóng chảy là 1713oC, tồn tại trong tự nhiên ở dạng cát và thạch anh.
- Tan chậm trong kiềm hoặc cacbonat kim loại kiềm nóng chảy:
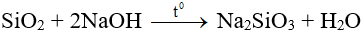
- Tác dụng với HF (dùng để khắc thủy tinh).
SiO2 + 4HF → SiF4 + 2H2O
3. Axit silixic (H2SiO3)
- Là chất keo, không tan trong nước. Khi sấy khô, axit silixic mất 1 phần nước tạo Silicagen (được dùng để hút ẩm):
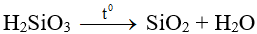
- H2SiO3 là axit rất yếu, yếu hơn H2CO3:
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
4. Muối silicat
- Muối silicat của kim loại kiềm tan trong nước và bị thủy phân mạnh tạo môi trường kiềm:
Na2SiO3 + 2H2O → 2NaOH + H2SiO3↓
File tải miễn phí hướng dẫn soạn Hóa học Lớp 11 Bài 19: Luyện tập trang 86:
Hy vọng tài liệu sẽ hữu ích cho các em học sinh và quý thầy cô tham khảo và đối chiếu đáp án chính xác.
Ngoài ra các em học sinh và thầy cô có thể tham khảo thêm nhiều tài liệu hữu ích hỗ trợ ôn luyện thi môn toán như đề kiểm tra, hướng dẫn giải sách giáo khoa, vở bài tập được cập nhật liên tục tại chuyên trang của chúng tôi.