Giải Hoá học 11 Bài 38: Hệ thống hóa về hiđrocacbon trang 172 SGK
Giải Hoá học 11 Bài 38: Hệ thống hóa về hiđrocacbon trang 172 SGK giúp các em ôn tập sâu kiến thức thông qua hướng dẫn giải bài tập trong sách giáo khoa bằng các phương pháp giải hay, ngắn gọn. Hỗ trợ các em học tập tốt môn Hoá lớp 11.
Giải bài tập SGK Hóa 11 Bài 38
Giải bài 1 trang 172 SGK Hóa 11
So sánh tính chất hoá học của:
a. Anken với ankin
b. Ankan với ankylbenzen
Cho ví dụ minh hoạ
Lời giải:
∗ So sánh tính chất hóa học anken và ankin:
- Giống nhau :
+ Cộng hiđro.
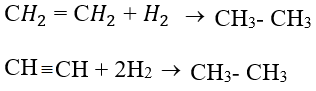
+ Cộng brom (dung dịch).
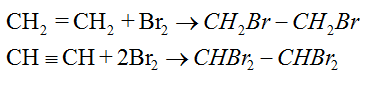
+ Cộng HX theo quy tắc Mac-côp-nhi-côp.
+ Làm mất màu dung dịch KMnO4.
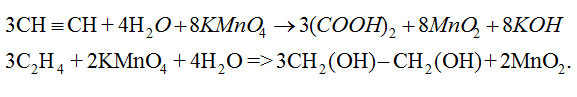
- Khác nhau :
+ Anken : Không có phản ứng thế bằng ion kim loại.
+ Ankin : Ank-1-in có phản ứng thế bằng ion kim loại.
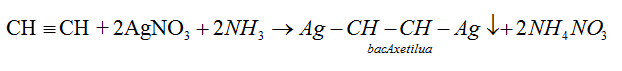
∗ So sánh tính chất hóa học ankan và ankybenzen:
- Giống nhau:
+ Phản ứng thế (halogen):
CH4 + Cl2 → CH3Cl + HCl
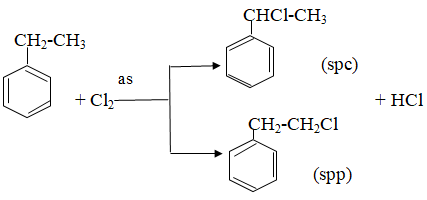
+ Phản ứng oxi hóa:
CH4 + 2O2 → CO2 +2H2O
C7H8 + 8O2 → 7CO2 + 4H2O
- Khác nhau:
+ Ankan: có phản ứng tách
C2H6 -500oC, xt→ CH2 = CH2 + H2
+ Ankylbenzen: có phản ứng cộng
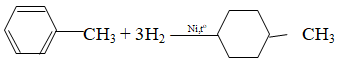
Giải bài 2 SGK Hóa 11 trang 172
Trình bày phương pháp hoá học
a. Phân biệt các bình đựng khí riêng biệt không dán nhãn: H2, O2, CH4, C2H4, C2H2
b. Tách riêng khí metan từ hỗn hợp với lượng nhỏ các chất C2H4, C2H2.
Lời giải:
a. Lấy các mẫu khí nhỏ từ các bình đừng khí và đánh số theo thứ tự.
- Cho tàn đóm qua các mẫu khí, mẫu nào làm tàn đóm bùng cháy thì đó là O2.
- Lần lượt dẫn các mẫu khí còn lại qua dung dịch AgNO3/NH3, mẫu khí nào làm dung dịch xuất hiện kết tủa vàng thì đó là C2H2.
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
- Lần lượt dẫn các mẫu khí còn lại qua dung dịch brôm, khí nào làm nhạt màu dung dịch brôm thì đó là C2H4.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
- Đốt cháy hai mẫu khí còn lại, dẫn sản phẩm qua bình đựng dung dịch Ca(OH)2 dư, nếu xuất hiện kết tủa trắng thì đó là CH4
2H2 + O2 → 2H2O
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
- Khí còn lại là H2
b. Cho hỗn hợp khí đi qua dung dịch Br2 dư, C2H4 và C2H2 sẽ tác dụng hết với dung dịch Br2, khí đi ra là metan.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
CH≡CH + 2Br2 (nâu đỏ) → Br2CH-CHBr2 (không màu)
Giải bài 3 SGK trang 172 Hóa 11
Viết các phương trình hoá học của các phản ứng hoàn thành dãy chuyển hoá sau:
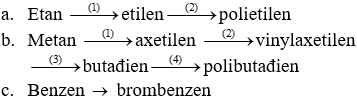
Lời giải:
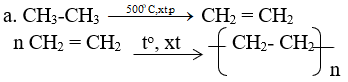
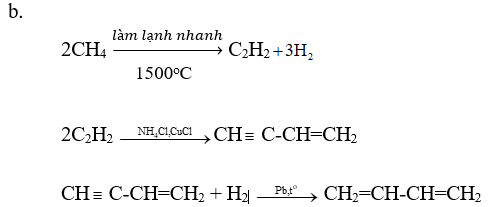
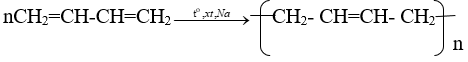
Giải bài 4 trang 172 Hóa 11 SGK
Viết phương trình hoá học tổng quát của phản ứng đốt cháy các loại hiđrocacbon đã nêu trong bảng 7.2. Nhận xét về tỉ lệ số mol CO2 và số mol H2O trong sản phẩm cháy của mỗi loại hiđrocacbon.
Lời giải:

Giải bài 5 Hóa 11 SGK trang 172
Khi đốt cháy hoàn toàn hiđrocacbon X (là chất lỏng ở điều kiện thường) thu được CO2 và H2O có số mol theo tỉ lệ 2:1. Công thức phân tử của X có thể là công thức nào sau đây?
A. C4H4 ; B. C5H12
C. C6H6 ; D. C2H2
Lời giải:
- Đáp án C
- Khi đốt cháy X thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1
⇒ X có số C bằng số H
Mà X là chất lỏng ở điều kiện thường nên X chỉ có thể là C6H6
Lý thuyết Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon
I. Hidrocacbon thơm
1. Đặc điểm cấu trúc và khả năng phản ứng
- Có vòng benzen. 6 nguyên tử Csp2 liên kết tạo thành lục giác đều.
- Các aren dễ thế, khó cộng, bền với chất oxi hóa.
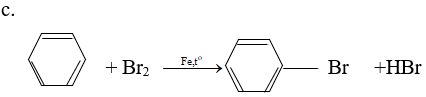
2. Phản ứng thế
- Halogen thế vào nhân khi có Fe xúc tác:
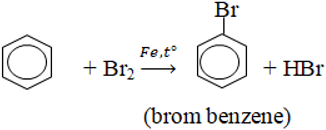
- Thế vào nhánh trong điều kiện chiếu sáng:
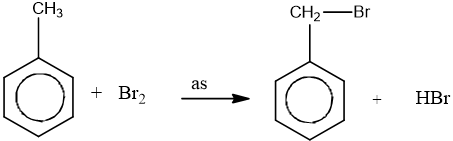
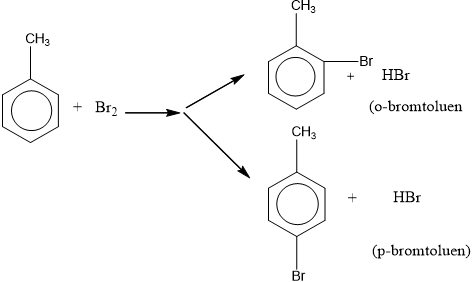
- Khi có sẵn nhóm thế ở nhân benzen, sản phẩm thế được định hưởng theo quy tắc sau:
+ Nếu vòng benzen đã có sẵn nhóm thế loại I (-OH, ankyl, -NH2, …) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
+ Nếu vòng benzen đã có sẵn nhóm thế loại II (-COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
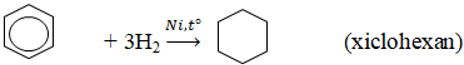
3. Phản ứng cộng
Đun nóng có xúc tác kim loại, aren cộng H2 tạo thành xicloankan.
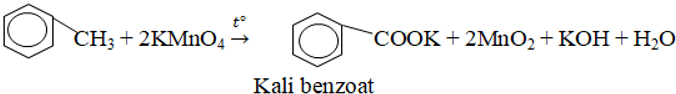
4. Phản ứng oxi hóa
- Cháy tỏa nhiều nhiệt.
- Vòng benzen không bị oxi hóa, nhánh ankykl bị oxi hóa thành nhóm –COOH.
Ví dụ:
II. Hidrocacbon no
1. Đặc điểm cấu trúc và khả năng phản ứng
- Chỉ có các nguyên tử Csp3.
- Tương đối trơ ở điều kiện thường.
2. Phản ứng thế
- Khi đun nóng hoặc chiếu sáng: Clo có thể thế ở nhiều vị trí khác nhau còn brom thế ở C bậc cao.
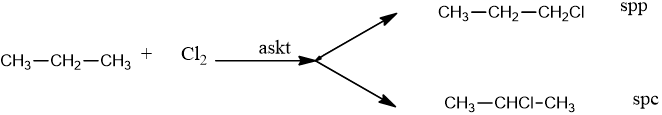
3. Phản ứng cộng
Không có phản ứng cộng (trừ xiclopropan và xiclobutan).
4. Phản ứng oxi hóa
- Cháy, tỏa nhiệt.
- Chỉ bị oxi hóa ở nhiệt độ cao hoặc có thêm xúc tác.
CnH2n+2 + O2 → nCO2 + (n + 1)H2O
III. Hidrocacbon không no
1. Đặc điểm cấu trúc và khả năng phản ứng
- Có C lai hóa sp2 hoặc sp.
- Trung tâm các phản ứng hóa học do các liên kết π kém bền.
- Phản ứng đặc trưng là phản ứng cộng.
2. Phản ứng thế
- Ở nhiệt độ cao, clo thế H ở C bên cạnh Csp2.
- Phản ứng thế của ank-1-in:
CH≡CH + AgNO3 + NH3 → CAg≡CAg↓ (Bạc Axetilen) + 2NH4NO3
3. Phản ứng cộng
- Anken, ankin dễ cộng với H2, HX (X: OH-, halogen).
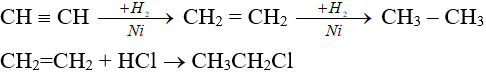
4. Phản ứng oxi hóa
- Cháy, tỏa nhiệt.
- Dễ bị oxi hóa bởi dd KMnO4 và các chất oxi hóa khác.
Ví dụ:
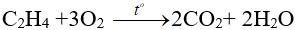
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải Hoá học 11 Bài 38: Hệ thống hóa về hiđrocacbon trang 172 SGK file PDF hoàn toàn miễn phí!