Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 12 Bài 18 SBT: Tính chất của kim loại. Dãy điện hóa của kim loại
Bài 18.1 trang 37 Sách bài tập Hóa học 12:
Dãy kim loại tác dụng được với H2O ở nhiệt độ thường là
A. Fe, Zn, Li, Sn. B. Cu, Pb, Rb, Ag.
C. K, Na, Ca, Ba. D. Al, Hg, Cs, Sr.
Lời giải:
C
Bài 18.2 trang 37 Sách bài tập Hóa học 12:
Ngâm một đinh sắt trong 100 ml dung dịch CuCl2 1M, giả thiết Cu tạo ra bám hết vào đinh sắt. Sau khi phản ứng xong lấy đinh sắt ra, sấy khô, khối lượng đinh sắt tăng thêm
A. 15,5 g. B. 0,8 g.
C. 2,7 g. D. 2,4 g.
Lời giải:
B
Fe + CuCl2 → FeCl2 + Cu
Theo phương trình ta có: Cứ 1 mol CuCl2 tham gia phản ứng với 56g Fe tạo ra 64g Cu tăng 64 -56 = 8g
⇒ 0,1 mol CuCl2 tham gia phản ứng khối lượng kim loại tăng = 0,1.8 = 0,8g
Bài 18.3 trang 37 Sách bài tập Hóa học 12:
Cho 4,8 g một kim loại R hoá trị II tác dụng hết với dung dịch HNO3 loãng, thu được 1,12 lít khí NO duy nhất (đktc). Kim loại R là
A. Zn. B. Mg
C. Fe. D. Cu.
Lời giải:
D
nNO = 1,12 : 22,4 = 0,05 mol
3R + 8HNO3 → 3R(NO3)2 + 2NO + 4H2O
Theo phương trình ta có: nR = 3/2nNO = 0,075 mol
⇒ R = 4,8 : 0,075 = 64 ⇒ Cu
Bài 18.4 trang 37 Sách bài tập Hóa học 12:
Cho 3,2 g Cu tác dụng với dung dịch HNO3 đặc, dư thì thể tích khí NO2 (đktc) thu được là
A. 1,12 lít. B. 2,24 lít.
C. 3,36 lít. D. 4,48 lít.
Lời giải:
B
nCu = 0,05 mol
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
0,05 → 0,1 (mol)
⇒ VNO2 = 0,1.22,4 = 2,24 lít
Bài 18.5 trang 38 Sách bài tập Hóa học 12:
Nung nóng 16,8 g bột sắt và 6,4 g bột lưu huỳnh (không có không khí) thu được sản phẩm X. Cho X tác dụng với dung dịch HCl dư thì có V lít khí thoát ra (đktc). Các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 2,24 B. 4,48.
C. 6,72. D. 3,36.
Lời giải:
C
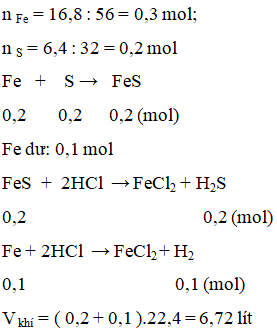
Bài 18.6 trang 38 Sách bài tập Hóa học 12:
Để khử hoàn toàn hỗn hợp gồm FeO và ZnO thành kim loại cần 2,24 lít H2 (đktc). Nếu đem hỗn hợp kim loại thu được cho tác dụng hết với dung dịch HCl thì thể tích khí H2 thu được là
A. 4,48 lít. B. 1,12 lít.
C. 3,36 lít. D. 2,24 lít.
Lời giải:
D
nhh oxit = nH2 = nhh kim loại = 2,24 : 22,4 = 0,1 mol
Khi cho hỗn hợp kim loại tác dụng với axit:
nH2 = nhh kim loại = 0,1 mol
VH2 = 22,4.0,1 = 2,24 lít
Bài 18.7 trang 38 Sách bài tập Hóa học 12:
Cho 6,72 lít khí H2 (đktc) đi qua ống đựng 32 g CuO nung nóng thu được chất rắn A. Thể tích dung dịch HCl 1M đủ để tác dụng hết với A là
A. 0,2 lít. B. 0,l lít.
C. 0,3 lít D. 0,01 lít.
Lời giải:
A
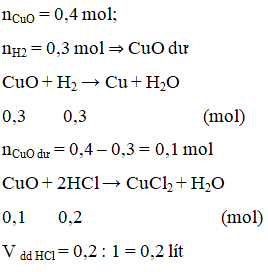
Bài 18.8 trang 38 Sách bài tập Hóa học 12:
Phản ứng : Cu + 2FeCl3 → 2FeCl2 +CuCl2 chứng tỏ
A. ion Fe2+ có tính oxi hoá mạnh hơn ion Fe2+.
B. ion Fe3+ có tính khử mạnh hơn ion Fe2+.
C. ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+.
D. ion Fe3+ có tính oxi hoá yếu hơn ion Cu2+.
Lời giải:
C
Bài 18.9 trang 38 Sách bài tập Hóa học 12:
Mệnh đề nào sau đây không đúng ?
A. Fe2+ oxi hoá được Cu.
B. Fe khử được Cu2+ trong dung dịch
C. Fe3+ có tính oxi hoá mạnh hơn Cu2+
D. Tính oxi hoá của các ion tăng theo thứ tự Fe2+, H+, Cu2+, Ag+.
Lời giải:
A
Bài 18.10 trang 38 Sách bài tập Hóa học 12:
Cho các phản ứng xảy ra sau đây :
(1) AgNO3 + Fe(NO3) → Fe(NO3)3+ Ag
(2) Mn + 2HC1 → MnCl2 + H2
Dãy các ion được sắp xếp theo chiều tăng dần tính oxi hoá là
A. Mn2+, H+, Fe3+, Ag+.
B. Ag+, Fe3+, H+, Mn2+.
C. Ag+, Mn2+, H+, Fe3+.
D. Mn2+, H+, Ag+, Fe3+.
Lời giải:
A
Bài 18.11 trang 39 Sách bài tập Hóa học 12:
Cho các phản ứng oxi hoá - khử sau :
Hg2+ + 2Ag → Hg + 2Ag+
Hg2+ + Cu → Hg + Cu2+
3Hg + 2Au3+ →3Hg2+ + 2Au
2Ag+ + Cu → 2Ag + Cu2+
Trong các chất cho ở trên, chất oxi hoá mạnh nhất là
A. Au3+. B. Hg2+.
C. Ag+. D. Cu2+.
Lời giải:
A
Bài 18.12 trang 39 Sách bài tập Hóa học 12:
Khi cho hỗn hợp kim loại gồm : Mg và Al vào dung dịch hỗn hợp chứa Cu(NO3)2 và AgNO3 thì phản ứng xảy ra đầu tiên là:
A. Mg + Cu2+ ⟶ Mg2+ + Cu
B. 2Al + 3Cu2+ ⟶ 2Al3+ + 3Cu
C. Mg + 2Ag+ ⟶ Mg2+ + 2Ag
D. Al + 3Ag+ ⟶ Al3+ + 3Ag
Lời giải:
C
Bài 18.13 trang 39 Sách bài tập Hóa học 12:
Cho một lá sắt nhỏ vào dung dịch chứa một trong những muối sau CuSO4, AlCl3, Pb(NO3)2, ZnCl2, KNO3, AgNO3. Viết phương trình hoá học dạng phân tử và ion thu gọn của các phản ứng xảy ra (nếu có). Cho biết vai trò của các chất tham gia phản ứng.
Lời giải:
Fe tác dụng được với các muối: CuSO4, Pb(NO3)2, AgNO3
+) Fe + CuSO4 →FeSO4+ Cu
Fe + Cu2+ → Fe2+ + Cu
Fe là chất khử , CuSO4 là chất oxi hoá
+) Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
Fe + Pb 2+ → Fe 2+ + Pb
Fe là chất khử, Pb(NO3)2 là chất oxi hóa
+) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + 2Ag+ → Fe2+ + 2Ag
Fe là chất khử, AgNO3 là chất oxi hóa
Nếu AgNO3 dư ta có pứ:
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
Ag+ + Fe2+ → Fe3+ + Ag
Bài 18.14 trang 39 Sách bài tập Hóa học 12:
Khối lượng thanh kẽm thay đổi thế nào sau khi ngâm một thời gian trong các dung dịch :
a) CuCl2
b) Pb(NO3)2
c) AgNO3
d) NiSO4.
Viết phương trình hoá học của các phản ứng xảy ra dưới dạng phân tử và ion thu gọn. Giả thiết các kim loại giải phóng ra đều bám hết vào thanh kẽm.
Lời giải:
a) Zn + CuCl2 → ZnCl2 + Cu
65g 64g
MCu < MZn → khối lượng giảm
b) Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
65g 207g
M Zn < M Pb → khối lượng tăng
c) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
65g 2.108g
2MAg > MZn → khối lượng tăng
d) Zn + NiSO4 → ZnSO4 + Ni
65g 59g
MZn > MNi → khối lượng giảm.
Bài 18.15 trang 40 Sách bài tập Hóa học 12:
Ngâm một đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô, nhận thấy khối lượng đinh sắt tăng thêm 0,8 g.
a) Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn. Cho biết vai trò của các chất tham gia phản ứng.
b) Tính nồng độ mol của dung dịch CuSO4.
Giả thiết Cu giải phóng ra đều bám hết vào đinh sắt.
Lời giải:
a) Fe + CuSO4 → FeSO4 + Cu (1)
Fe + Cu2+ → Fe2+ + Cu (2)
Chất khử chất oxi hóa
b) Theo (1) cứ 1 mol CuSO4 phản ứng làm khối lượng đinh sắt tăng 8 g
x mol → 0,8 g
x = 1.0,8/8 = 0,1 mol
Nồng độ mol của dung dịch CuSO4 là :
0,1.1000/200 = 0,5M
Bài 18.16 trang 40 Sách bài tập Hóa học 12:
Cho 1,5 g hỗn hợp bột Al và Mg tác dụng hết với dung dịch HCl thu được 1,68 lít H2 (đktc). Tính phần trăm khối lượng của từng kim loại trong hỗn hợp.
Lời giải:
2Al + 6HCl → 2AlCl3 + 3H2
x 3/2y (mol)
Mg + 2HCl → MgCl2 + H2
y y (mol)
Ta có hệ phương trình : 27x + 24y = 1,5
3x/2 + y = 1,68/22,4 = 0,075
Giải hệ phương trình rồi tính phần trăm khối lượng của từng kim loại được : %mAl = 60% ; %mMg = 40%.
Bài 18.17 trang 40 Sách bài tập Hóa học 12:
Đốt cháy hết 1,08 g một kim loại hoá trị III trọng khí Cl2 thu được 5,34 g muối clorua của kim loại đó. Xác định kim loại.
Lời giải:
2M + 3C12 → 2MCl3 (1)
Số mol Cl2 đã phản ứng là : (5,34-1,08)/71 = 0,06 mol
Theo (1) số mol kim loại phản ứng là : 0,06.2/3 = 0,04 mol
Khối lượng mol của kim loại là : 1,08/0,04 = 27 (g/mol)
Kim loại là Al.
Bài 18.18 trang 40 Sách bài tập Hóa học 12:
Cho 1,12 g bột sắt và 0,24 g bột Mg vào một bình chứa 250 ml dung dịch CuSO4 rồi khuấy kĩ cho đến khi kết thúc phản ứng. Sau phản ứng, khối lượng kim loại có trong bình là 1,88 g. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
Lời giải:
Khối lượng kim loại tăng là : 1,88 - 1,12 - 0,24 = 0,52 (g)
Mg là kim loại mạnh hơn Fe nên Mg phản ứng trước.
Mg + CuSO4 → MgSO4 + Cu (1)
0,01 → 0,01 (mol)
Mg phản ứng hết làm khối lượng tăng là :
64 . 0,01 - 24 . 0,01 = 0,40 (g)
Phản ứng của Fe làm khối lượng tăng thêm là : 0,52 - 0,40 = 0,12(g)
Fe + CuSO4 → FeSO4 + Cu (2)
Theo (2), ta có:
1 mol CuSO4 phản ứng làm khối lượng tăng 64 - 56 = 8 (g)
x mol → 0,12 g
x = 0,12/8 = 0,015 mol
Số mol Fe ban đầu là 1,12/56 = 0,02 mol > 0,015 mol
Vậy Fe còn dư và CuSO4 hết.
Nồng độ mol của CuSO4 là : (0,01 + 0,015).1000/250 = 0,1M
Bài 18.19 trang 40 Sách bài tập Hóa học 12:
Cho 8,85 g hỗn hợp Mg, Cu và Zn vào lượng dư dung dịch HCl thu được 3,36 lít H2 (đktc). Phần chất rắn không phản ứng với axit được rửa sạch rồi đốt cháy trong oxi tạo ta 4 g chất bột màu đen.
Tính phần trăm khối lượng của từng kim loại trong hỗn hợp.
Lời giải:
Mg + 2HCl → MgCl2 + H2
Zn + 2HCl → ZnCl2 + H2
Cu không phản ứng với dung dịch HCl.
2Cu + O 2 → 2CuO
Khối lương Cu là: 4/80.64 = 3,2g
Đặt số mol Mg và Zn lần lượt là x và y. Ta có : 24x + 65y = 8,85- 3,2 = 5,65 (1)
Số mol H2 là : x + y = 3,36/22,4 = 0,15 (2)
Giải hệ gồm phương trình (1) và (2) được x = 0,1 ; y = 0,05
%mMg = 0,1.24/8,85 x 100% = 27,12%
%mZn = 0,05.65/8,85 x 100% = 36,72%
&mCu = 100 - 27,12 - 36,72 = 36,16%
Bài 18.20 trang 40 Sách bài tập Hóa học 12:
Tính thể tích dung dịch HNO3 1M ít nhất cần dùng để tác dụng hết với hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu. Cho biết phản ứng tạo sản phẩm khử duy nhất là NO.
Lời giải:
Nhận thấy nếu Fe bị oxi hóa thành Fe3+ thì lượng Fe3+ tạo ra cũng không đủ hoà tan hết bột Cu do đó axit HNO3 hoà tan hết Fe và có phản ứng với Cu một lượng x mol. Sử dụng phương trình bán phản ứng và phương trình ion rút gọn ta có:
Fe → Fe3+ + 3e 4HNO3 + 3e → NO + 3NO3- + 2H2O
0,15 → 0,45(mol) 0,6 ←0,45 (mol)
Cu → Cu + 2e 4HNO3+ 3e → NO + 3NO3- + 2H2O
x → 2x (mol) ← 2x (mol)
Lượng Cu còn lại do Fe3+ hoà tan : 2Fe3+ + Cu → 2Fe2++ Cu2+
0,15 →0,075(mol)
Số mol Cu = 0,075 + x = 0,15 → x = 0,075 (mol)
Vậy số mol HNO3 phản ứng là: 0,6 + 8.0,075/3 = 0,8 mol
VHNO3 = 0,8l
Bài 18.21 trang 40 Sách bài tập Hóa học 12:
Tiến hành hai thí nghiệm sau :
- Thí nghiệm 1 : Cho m gam bột Fe (dư) vào V1 lít dung dịch Cu(NO3)2 1M.
- Thí nghiệm 2 : Cho m gam bột Fe (dư) vào V2 lít dung dịch AgNO3 0,1M.
Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở hai thí nghiệm đều bằng nhau. Lập biểu thức biểu diễn mối quan hộ giữa V1 và V2.
Lời giải:
Do Fe dư nên cả hai trường hợp muối đều phản ứng hết.
Thí nghiệm 1: khối lượng rắn thu được là:
m1 = m + (64-56).V1(gam)
Thí nghiệm 2 : khối lượng rắn thu được là:
m2 = m + (108.0,1V2 - 56.0,1V2/2) (g)
mà m1 = m2 => V1 = V2
Bài 18.22 trang 40 Sách bài tập Hóa học 12:
Cho 1,84 g hỗn hợp Fe và Mg vào lượng dư dung dịch HNO3 thấy thoát 0,04 mol khí NO duy nhất. Xác định số mol Fe và Mg trong hỗn hợp
Lời giải:
Đặt x,y lần lượt là số mol Fe và Mg
Sử dụng phương trình cho - nhận e và áp dụng định luật bảo toàn điện tích ta có
Fe → Fe3+ + 3e
x &rarrr; 3x (mol)
N+5 + 3e → N+2
0,12 → 0,04
Mg → Mg2+ + 2e
y → 2y mol
Ta có 3x + 2y = 0,12
Mặt khác khối lượng hỗn hợp: mhh = 56x + 24y = 1,84
Giải hệ ta có x = 0,02; y = 0,03
Bài 18.23 trang 41 Sách bài tập Hóa học 12:
Cho 0,04 mol Fe vào dung dịch chứa 0,08 mol HNO3 thấy thoát ra khí NO duy nhất. Sau khi phản ứng kết thúc thì khối lượng muối thu được là bao nhiêu
Lời giải:
Sử dụng pt cho- nhận e và pt bán pứ, ta có:
Fe → Fe3+ + 3e 4HNO3 + 3e → NO + 3NO3- + 2H2O
0,02 ← 0,02 ← 0,06 (mol) 0,08 → 0,06 (mol)
Fe dư: 0,02 mol
Fe + 2Fe3+ → 3Fe2+
0,01 ← 0,02 → 0,03 (mol)
Muối thu được là Fe(NO3)2 : 0,03mol → m Fe(NO3)2 = 5,4g.
Bài 18.24 trang 41 Sách bài tập Hóa học 12:
Cho 0,04 mol bột Fe vào dung dịch chứa 0,07 mol AgNO3. Khi phản ứng xảy ra hoàn toàn thì khối lượng chất rắn thu được là bao nhiêu
Lời giải:
Sử dụng phương trình cho – nhận e ta có:
Fe → Fe2+ + 2e Ag+ + 1e → Ag
0,035 ← 0,035 ← 0,07 0,07 → 0,07 → 0,07
Chất rắn thu được sau phản ứng gồm: Ag 0,07 mol và Fe dư 0,005 mol.
→ mrắn = 0,07.108 + 0,005.56 = 7.84 (g)
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 12 Bài 33: Hợp kim của sắt (chính xác nhất)
- Giải SBT Hóa học 12 Bài 7: Luyện tập: Cấu tạo và tính chất của cacbohiđrat (chính xác nhất)
- Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
- Giải SBT Hóa học 12 Bài 13: Đại cương về polime (chính xác nhất)
- Giải SBT Hóa học 12 Bài 1: Este (chính xác nhất)
- Giải SBT Hóa học 12 Bài 6: Saccarozơ, tinh bột và xenlulozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 5: Glucozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 34: Crom và hợp chất của crom (chính xác nhất)