Giải SBT Hóa học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng (Chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 12 Bài 28 SBT: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
Bài 28.1 trang 65 Sách bài tập Hóa học 12:
Có 3 lọ, mỗi lọ đựng một dung dịch sau: BaCl2, Ba(NO3)2, Ba(HCO3)2. Chỉ dùng thuốc thử nào sau đây có thể nhận biết được các dung dịch trên
A. Quỳ tím.
B. Phenolphtalein.
C. Na2CO3
D. AgNO3.
Lời giải:
D
Bài 28.2 trang 65 Sách bài tập Hóa học 12:
Điện phân nóng chảy 4,25 g muối clorua của một kim loại kiềm thu được 1,568 lít khí tại anot (đo ở 109,2°c và 1 atm). Kim loại kiềm đó là
A. Li.
B. Na.
C. K.
D. Rb.
Lời giải:
A
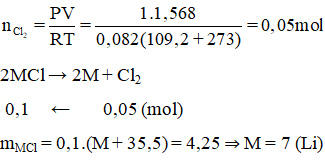
Bài 28.3 trang 66 Sách bài tập Hóa học 12:
Cho 21,6 g một kim loại chưa biết hoá trị tác dụng hết với dung dịch HNO3 loãng thu được 6,72 lít N2O duy nhất (đktc). Kim loại đó là
A. Na.
B. Zn.
C. Mg.
D. Al.
Lời giải:
A
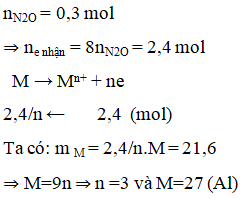
Bài 28.4 trang 66 Sách bài tập Hóa học 12:
Sục 11,2 lít khí SO2 (đktc) vào dung dịch NaOH dư, dung dịch thu được cho tác dụng với BaCl2 dư thì khối lượng kết tủa thu được là
A. 107,5 g.
B. 108,5g
C. 106,5 g.
D. 105,5g.
Lời giải:
B
nSO2 = nNa2SO3 = nBaSO3 = 0,5 mol
⇒ m↓ = 0,5.217 = 108,5g
Bài 28.5 trang 66 Sách bài tập Hóa học 12:
Sục V lít khí SO2 (đktc) vào dung dịch brom dư thu được dung dịch X. Cho BaCl2 dư vào dung dịch X thu được 23,3 g kết tủa. V có giá trị là
A. 1,12
B. 2,24.
C. 3,36.
D. 6,72.
Lời giải:
B
Bảo toàn nguyên tố S ta có: nBaSO4 = nSO2 = 23,3 : 233 = 0,1 mol
⇒ V = 0,1.22,4 = 2,24 lít
Bài 28.6 trang 66 Sách bài tập Hóa học 12:
Cho 5,75 g hỗn hợp Mg, Al và Cu tác dụng với dung dịch HNO3 loãng, dư thu được 1,12 lít (đktc) hỗn hợp khí X gồm NO và N2O (đktc). Tỉ khối của X đối với khí H2 là 20,6. Khối lượng muối nitrat sinh ra trong dung dịch là
A. 27,45 g.
B. 13,13 g.
C. 58,91 g
D. 17,45 g.
Lời giải:
A
MX = 20,6.2 = 41,2; nX = 0,05 mol
Sử dụng sơ đồ đường chéo ta có: nN2O = 4nNO
⇒nN2O = 0,04 mol; nNO = 0,01 mol
ne nhận = 8nN2O + 3nNO = 0,35 mol
Ta có: nNO3- trong muối = ne = 0,35
mmuối = mKL + mNO3- = 5,75 + 0,35.62 = 27,45g
Bài 28.7 trang 66 Sách bài tập Hóa học 12:
Xác định các chất trong chuỗi phản ứng :
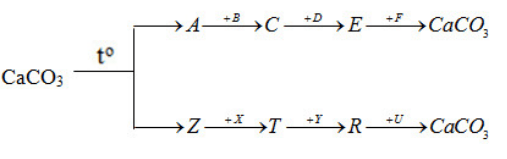
Lời giải:
A: CaO B: H2O
C: Ca(OH)2 D: HCl
E: CaCl2 F: Na2CO3 Z: CO2
X: Ba(OH)2 T: Ba(HCO3)2
Y: KOH R: K2CO3 U: Ca(NO3)2
Bài 28.8 trang 66 Sách bài tập Hóa học 12:
Xác định các chất trong chuỗi phản ứng sau :
A + B → C + H2O
B to→ C + H2O + D
D+ A → B hoặc C
Biết D là hợp chất của cacbon. A, B, C là hợp chất của một kim loại, khi đốt nóng cho ngọn lửa màu vàng.
Lời giải:
A: NaOH B: NaHCO3 C: Na2CO3 D: CO2
Bài 28.9 trang 67 Sách bài tập Hóa học 12:
Cho các chất : MgCO3, MgO, Mg(OH)2, MgCl2, MgSO4. Hãy viết PTHH của các chuỗi phản ứng có thể xảy ra theo sơ đồ:
A ⟶ B ⟶ C ⟶ D ⟶ E
Lời giải:
Có nhiều chuỗi phản ứng phù hợp sơ đồ trên. Ví dụ :
MgO ⟶ MgCl2 ⟶ MgCO3 ⟶ MgSO4 ⟶ Mg(OH)2
MgO ⟶ MgSO4 ⟶ MgCO3 ⟶ MgCl2 ⟶ Mg(OH)2
MgCO3 ⟶ MgO ⟶ MgCl2 ⟶ MgSO4 ⟶ Mg(OH)2
Mg(OH)2 ⟶ MgCl2 ⟶ MgCO3 ⟶ MgO ⟶ MgSO4
Bài 28.10 trang 67 Sách bài tập Hóa học 12:
Ion Ca2+ có cấu hình electron giống với cấu hình electron của nguyên tử khí hiếm và ion halogen nào ? Viết cấu hình electron của chúng.
Lời giải:
Cấu hình của ion Ca2+ : 1 s22s22p63s23p6. Giống cấu hình electron của nguy tử khí hiếm đứng trước nó là agon (Ar) và cấu hình electron của ion Cl-
Bài 28.11 trang 67 Sách bài tập Hóa học 12:
Bằng những phản ứng hoá học nào có thể phân biệt được các chất trong mỗi dãy sau ?
a) Các kim loại : Al, Mg, Ba, Na.
b) Các dung dịch muối : NaCl, Ba(NO3)2, Al(SO4)3.
c) Các oxit : CaO, FeO, Al2O3.
d) Các dung dịch : NaNO3, Ca(NO3)2, Al(NO3)3.
Lời giải:
a) Dùng H2O, nhận biết được 2 nhóm kim loại Na, Ba và Mg, Al. Nhận biết ion Ba2+ trong nhóm ( 1 ) bằng ion CO32-. Nhận biết kim loại Al trong nhóm (2) bằng dung dịch NaOH.
b) Nhận biết ion Al3+ bằng dung dịch NaOH, sau đó nhận biết ion Ba2+ bằng dung dịch muối cacbonat, còn lại là dung dịch chứa Na+.
c) Dùng H2O nhận biết CaO, dùng dung dịch NaOH nhận biết Al2O3, chất còn lại là FeO.
d) Dùng dung dịch NaOH nhận biết: Al(NO3)3 tạo kết tủa sau đó tan trong dung dịch NaOH dư ; Ca(NO3)2 làm dung dịch vẩn đục, còn lại là NaNO3.
Bài 28.12 trang 67 Sách bài tập Hóa học 12:
Trình bày phương pháp điều chế từng kim loại riêng biệt từ hỗn hợp những chất NaCl, Al2O3, MgCO3. Viết các phương trình hoá học.
Lời giải:
Dùng nước tách được NaCl. Cô cạn dung dịch được NaCl rắn. Điện phân NaCl nóng chảy, được kim loại Na.
Dùng dung dịch NaOH dư, tách được chất rắn MgCO3 và dung dịch NaAlO2. Từ MgCO3 điều chế kim loại Mg theo sơ đồ chuyển hoá sau:
MgCO3 to→ MgO ddHCl→ MgCl2 đpnc→ Mg
Từ natri aluminat điều chế Al theo sơ đồ chuyển hóa:
NaAlO2 CO2→ Al(OH)3 to→ Al2O3 đpnc→ Al
Bài 28.13 trang 67 Sách bài tập Hóa học 12:
Một hỗn hợp rắn gồm Ca và CaC2 tác dụng với nước (dư) thu được hỗn hợp khí có tỉ khối đối với H2 là 5. Đế trung hoà dung dịch sau phản ứng, cần dùng 600 ml dung dịch HCl 0,5M. Tính :
a) Khối lượng của hỗn hợp rắn đã dùng ban đầu.
b) Thành phần phần trăm thể tích của hỗn hợp khí
Lời giải:
a) Ca + H2O → Ca(OH)2 + H2 (1)
CaC2 + 2H2O → Ca(OH)2 + C2H2 (2)
Ca(OH)2 + 2HCl→ CaCl2 + 2H2O (3)
nHCl = 0,3 mol
Đặt x, y lần lượt là số mol Ca và CaC2 . Hỗn hợp khí thu được gồm H2 (x mol) và C2H2 (y mol)
Ta có hệ pt:
x + y = 0,15
(2x+26y)/(x+y) = 10
→ x= 0,1 mol ; y= 0,05 mol
Khối lượng hỗn hợp rắn ban đầu:
m Ca= 40.0,1 = 4 g
mCaC2= 64.0,05 = 3,2 g
→m hh= 7,2g
b) %VH2 = 0,1/0,15 x 100% = 66,67%
%VC2H2 = 33,33%
Bài 28.14 trang 67 Sách bài tập Hóa học 12:
Một bình kín có dung tích 5 lít chứa khí ở áp suất 1,4 atm và 27°c. Đốt cháy 12 g kim loại kiềm thổ trong bình kín trên. Sau phản ứng, nhiệt độ và áp suất trong bình là 136,5°C và 0,903 atm. Biết thể tích bình không đổi, thể tích chất rắn không đáng kể. Xác định kim loại kiềm thổ đem đốt.
Lời giải:
2M + O2 → 2MO
Thể tích O2 (đktc) có trong bình trước phản ứng:
V = (273.1,45)/(273+27) = 6,37l
Thể tích khí O2 còn lại trong bình sau phản ứng:
V' = (273.0,903.5)/(273+136,5) = 3,01l
Thể tích khí O2 tham gia phản ứng: 6,37- 3,01= 3,36 l hay 0,15 mol O2.
→ số mol kim loại tham gia phản ứng là 0,3 mol
Khối lượng mol của M là 12/0,3 = 40 (g/mol)
M là canxi.
Bài 28.15 trang 67 Sách bài tập Hóa học 12:
Hoà tan 1,04 g muối clorua của kim loại kiềm thổ trong nước thu được dung dịch A. Thêm Na2CO3 dư vào dung dịch A được một kết tủa. Hoà tan kết tủa này trong dung dịch HNO3 được dung dịch B. Thêm H2SO4 dư vào dung dịch B được kết tủa mới có khối lượng 1,165 g. Xác định công thức hoá học của muối clorua kim loại kiềm .
Lời giải:
MCl2 Na2CO3→ MCO3 HNO3→ M(NO3)2 H2SO4→ MSO4
Đặt X là khối lượng mol của kim loại kiểm thổ.
Theo sơ đồ phản ứng : 1 mol MCl2 → 1 mol MSO4
(X + 71) g MCl2 → (X + 96) g MSO4
1,04 g MCl2 → 1,165 g MSO4
⟹ 1,165.(X + 71) = 1,04.(X + 96)
Giải ra được X = 137. Vậy M là Ba, muối là BaCl2.
Bài 28.16 trang 68 Sách bài tập Hóa học 12:
Cho 10,6 g hỗn hợp A gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với 300 ml dung dịch HCl 1M (loãng), thu được dung dịch B và 5,6 lít khí (đktc).Dẫn từ từ khí CO2 vào dung dịch B. Số gam kết tủa cực đại thu được là bao nhiêu.
Lời giải:
Đặt hai kim loại là R_ có hoá trị n (1 < n < 2), ta có phương trình cho nhận e :
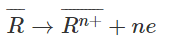
2H+ + 2e → H2
Với số mol H2 là 0,25 (mol) ⟹ số mol R là 0,5/n mol
=> MR = 21,2n
Với 1 ≤ n ≤ 2 → 21,2 ≤ MR ≤ 42,2
Vậy 2 kim loại cần tìm có thể là 2 trong 4 kim loại sau : Na, K, Mg, Ca.
Mặt khác ta có : nHCl = 0,3 mol ⟹ nH2 = 0,15mol, vậy 0,1 mol H2 còn lại do H2O phản ứng tạo ra ⟹ loại Mg vì Mg không phản ứng với nước
⟹ hai kim loại là Na và Ca với số mol tương ứng là x và y
Ta có hệ:
23x + 40y = 10,6 (1)
x + 2y = 0,25.2 = 0,5 (2)
từ (1) và (2) ⟶ x = 0,2 ; y = 0,15
Ta lại có số mol Họ do nước tạo ra là 0,1 mol ⟹ số mol OH- là 0,2 mol
Để tạo kết tủa cực đại tức là toàn bộ CO2 tạo muối CO32-
nOH/nCO2 = 2 => nCO32- = nCO2 = 0,2/2 = 0,1 mol
Vậy kết tủa là CaCO3 : 0,1 mol ⟹ m = 0,1.100 = 10 (gam).
Bài 28.17 trang 68 Sách bài tập Hóa học 12:
Hoà tan 0,1 mol phèn nhôm - amoni (NH4)2SO4.Al2(SO4)3.24H2O vào nước được dung dịch X. Cho đến dư dung dịch Ba(OH)2 vào dung dịch X (đun nóng) thì thu được kết tủa Y và khí Z. Xác định khối lượng kết tủa Y và thể tích (đktc) khí Z.
Lời giải:
- Dung dịch Ba(OH)2 dư nên Al(OH)3 sinh ra rồi tan hết.
- Phèn amoni (NH4)2SO4.Al2(SO4)3.24H2O: 0,1 mol
⟹ nSO42- = 0,4 mol và nNH4+ = 0,2 mol
Kết tủa Y : Ba2+ + SO42- → BaSO4 ↓
→m↓ = mBaSO4 = 0,4.233 = 93,2 (g)
Khí Z : NH4+ + OH- → NH3↑ + H2O
⟹ VNH3 = 0,2.22,4 = 4,48 (lít).
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 12 Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 12 Bài 33: Hợp kim của sắt (chính xác nhất)
- Giải SBT Hóa học 12 Bài 7: Luyện tập: Cấu tạo và tính chất của cacbohiđrat (chính xác nhất)
- Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
- Giải SBT Hóa học 12 Bài 13: Đại cương về polime (chính xác nhất)
- Giải SBT Hóa học 12 Bài 1: Este (chính xác nhất)
- Giải SBT Hóa học 12 Bài 6: Saccarozơ, tinh bột và xenlulozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 5: Glucozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 34: Crom và hợp chất của crom (chính xác nhất)