Giải SBT Hóa học 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc (Chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 12 Bài 36 SBT: Sơ lược về niken, kẽm, chì, thiếc
Bài 36.1 trang 87 Sách bài tập Hóa học 12:
Để làm sạch một loại thuỷ ngân có lẫn tạp chất là Zn, Sn và Pb cần khuấy loại thuỷ ngân này trong
A. dung dịch Zn(NO3)2.
B. dung dịch Sn(NO3)2.
C. dung dịch Pb(NO3)2.
D. dung dịch Hg(NO3)2.
Lời giải:
D
Bài 36.2 trang 87 Sách bài tập Hóa học 12:
Hai mẫu kẽm có khối lượng bàng nhau. Cho một mẫu tác dụng hoàn toàn với dung dịch HCl tạo ra 6,8 g muối. Cho mẫu còn lại tác dụng hoàn toàn với dung dịch H2SO4 thì khối lượng muối được tạo ra là
A.16,1 g.
B. 8,05 g.
C. 13,6 g.
D. 7,42 g.
Lời giải:
B
mZnCl2 = 6,8g ⟹ nZnSO4 = nZn = nZnCl2 = 6,8 : 136 = 0,05 mol
⟹ mZnSO4 = 0,05.161 = 8,05g
Bài 36.3 trang 88 Sách bài tập Hóa học 12:
Cho 20,4 g hỗn hợp Mg, Zn, Ag vào cốc đựng 600 ml dung dịch HCl 1M (vừa đủ). Sau khi phản ứng kết thúc, thêm dần NaOH vào để đạt được kết tủa tối đa. Lọc kết tủa và nung nóng ở nhiệt độ cao đến khối lượng không đổi được a gam chất rắn. Giá trị của a là
A. 23,2.
B. 25,2.
C.27,4.
D. 28,1
Lời giải:
B
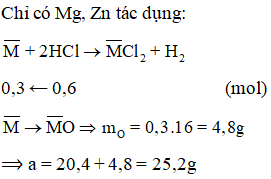
Bài 36.4 trang 88 Sách bài tập Hóa học 12:
Ngâm một bản kẽm vào 0,2 lít dung dịch AgNO3. Sau khi phản ứng kết thúc lấy bản kẽm ra, sấy khô, thấy khối lượng bản kẽm tăng 15,1 g. Nồng độ mol của dung dịch AgNO3 là
A. 0,5M
B. 1M
C.0,75M
D.1,5M
Lời giải:
B
Zn + 2AgNO3 ⟶ Zn(NO3)2 + 2Ag
Ta thấy cứ 2 mol AgNO3 phản ứng ⟶ 2 mol Ag làm cho bản kẽm tăng: 108.2 – 65 = 151g
Khối lượn bản kẽm tăng 15,1g ⟹ nAgNO3 = 15,1.2/151 = 0,2 mol
CM = 0,2 : 0,2 = 1M
Bài 36.5 trang 88 Sách bài tập Hóa học 12:
Nhận định nào dưới đây không đúng ?
A. Hỗn hợp PbS, CuS có thể tan hết trong dung dịch HCl.
B. Hỗn hợp Na, Al có thể tan hết trong dung dịch NaCl.
C. Hỗn hợp Fe3O4, Cu có thể tan hết trong dung dịch H2SO4 loãng.
D. Hỗn hợp Cu, KNO3 có thể tan hết trong dung dịch HCl.
Lời giải:
A
Bài 36.6 trang 88 Sách bài tập Hóa học 12:
Các hợp chất trong dãy nào dưới đây đều có tính lưỡng tính ?
A. Cr(OH)3, Fe(OH)2, Mg(OH)2
B. Cr(OH)3, Zn(OH)2, Mg(OH)2.
C. Cr(OH)3, Zn(OH)2, Pb(OH)2.
D. Cr(OH)2, Al(OH)3, Zn(OH)2.
Lời giải:
C
Bài 36.7 trang 88 Sách bài tập Hóa học 12:
Có các nhận định sau :
1. Ag, Au không bị oxi hoá trong không khí, dù ở nhiệt độ cao.
2. Ag, Au tác dụng được với axit có tính oxi hoá mạnh như HNO3 đặc nóng.
3. Zn, Ni tác dụng với không khí, nước ở nhiệt độ thường.
4. Ag, Au chỉ có số oxi hoá +1, còn Ni, Zn chỉ có số oxi hoá +2
5. Au bị tan trong nước cường toan.
Những nhận định không đúng là
A. 2, 3,4
B. 1,2, 3.
C. 2, 4, 5
D. 3, 4, 5.
Lời giải:
A
Bài 36.8 trang 89 Sách bài tập Hóa học 12:
Có thế phân biệt 2 kim loại Al và Zn bằng 2 thuốc thử là
A. dung dịch NaOH và dung dịch HCl.
B. dung dịch NH3 và dung dịch NaOH.
C. dung dịch NaOH và khí CO2.
D. dung dịch HCl và dung dịch NH3.
Lời giải:
D
Bài 36.9 trang 89 Sách bài tập Hóa học 12:
Có các dung dịch CaCl2, ZnSO4, Al2(SO4)3, CuCl2, FeCl3. Dùng thuốc thử nào dưới đây đế phân biệt được các dung dịch trên ?
A. Dung dịch NaOH
B. Dung dịch BaCl2.
C. Dung dịch NH3.
D. Dung dịch NaOH và CO2.
Lời giải:
C
Bài 36.10 trang 89 Sách bài tập Hóa học 12:
Những bức tranh cổ thường được vẽ bằng bột “trắng chì” có công thức là Pb(OH)2.PbCO3, lâu ngày thường bị xám đen. Để phục hồi những bức tranh đó người ta phun lên bức tranh nước oxi già H2O2, bức tranh sẽ trắng trở lại. Viết phương trình hoá học của phản ứng để giải thích việc làm trên.
Lời giải:
Pb(OH)2.PbCO3 lâu ngày tác dụng dần với khí H2S cò trong không khí tạo ra PbS màu đen :
Pb(OH)2 + H2S →PbS↓+ 2H2O
Phun dung dịch H2O2 sẽ làm cho PbS chuyển thành PbSO4 màu trắng :
PbS + 4H2O2 → PbSO4↓ + 4H2O.
Bài 36.11 trang 89 Sách bài tập Hóa học 12:
Có hỗn hợp bột các kim loại Al và Zn. Trình bày phương pháp hoá học tách riêng từng kim loại và viết phương trình hoá học của các phản ứng đã dùng.
Lời giải:
- Hoà tan hỗn hợp vào dung dịch HCl dư :
2A1 + 6HCl → 2AlCl3 + 3H2
Zn + 2HCl → ZnCl2 + H2
Dung dịch thu được cho tác dụng với dung dịch NH3 dư :
HCl (dư) + NH3 → NH4Cl
AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓+ 3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2↓ + 2NH4Cl
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Lọc tách Al(OH)3, nhiệt phân thu được Al2O3 rồi điện phân nóng chảy.
Nước lọc cho tác dụng với dung dịch HCl thu được Zn(OH)2, nhiệt phân thành ZnO rồi khử bằng H2.
Bài 36.12 trang 89 Sách bài tập Hóa học 12:
Các quá trình oxi hoá và khử xảy ra ở các điện cực có giống nhau không nếu điện phân dung dịch NiSO4 với
a) Các điện cực trơ (Pt)
b) Các điện cực tan (Ni)
Lời giải:
Khi điện phân dung dịch NiSO4 với :
Điện cực trơ :
Ở catot xảy ra sự khử các ion Ni2+ thành Ni kim loại.
Ở anot xảy ra sự oxi hoá các phân tử H2O sinh ra khí O2.
Điện cực tan :
Ở catot xảy ra sự khử các ion Ni2+ thành Ni kim loại.
Ở anot xảy ra sự oxi hoá điện cực Ni thành các ion Ni2+ .
Bài 36.13 trang 89 Sách bài tập Hóa học 12:
Cho 100 g hợp kim của Zn và Cu tác dụng với dung dịch HCl dư. Khí sinh ra trong phản ứng đã khử hoàn toàn một lượng Fe2O3 (làm giảm là 9,6 g so với ban đầu). Xác định thành phần phần trăm của hợp kim.
Lời giải:
Hợp kim Zn và Cu phản ứng với HCl thì chỉ có Zn phản ứng tạo khí còn Cu không phản ứng.
Các phản ứng hóa học xảy ra:
Zn + 2HCl → ZnCl2 + H2↑ (1)
3H2 + Fe2O3 → 2Fe + 3H2O (2)
Theo đề, khí sinh ra trong phản ứng đã khử hoàn toàn một lượng Fe2O3 (làm giảm là 9,6 g so với ban đầu) → m giảm = m O trong oxit = 9,6 → n O trong oxit = 0,6 mol
→ nFe2O3 = 0,6: 3= 0,2 mol → theo (2) n H2 = 3n Fe2O3 = 0,6 mol
Theo (1) n Zn = n H2 = 0,6 mol → m Zn = 0,6.65= 39g
→ % m Zn = 39% → % m Cu= 61%.
Bài 36.14 trang 89 Sách bài tập Hóa học 12:
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi phản ứng kết thúc, lọc bỏ phần dung dịch thu được m gam chất rắn. Tính phần trăm khối lượng của Zn trong hỗn hợp.
Lời giải:
Vì CuSO4 dư nên Zn và Fe phản ứng hết. Gọi x, y là số mol Fe và Zn
Fe + Cu2+ → Fe2+ + Cu
x → x (mol)
Zn + Cu2+ → Zn2+ + Cu
y → y (mol)
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau
⟹ 56x + 65y = 64x + 64y => y = 8x
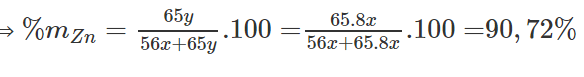
Bài 36.15 trang 89 Sách bài tập Hóa học 12:
Cho 11,9 gam hỗn hợp Al, Zn tác dụng hết với dung dịch HCl thu được dung dịch X và một lượng H2 vừa đủ để khử 32 gam CuO. Tính tổng khối lượng muối tạo ra trong dung dịch X.
Lời giải:
CuO + H2 to→ Cu + H2O
nCuO = 0,4 mol → nH2 = 0,4 ⟹ nHCl = 0,8 mol
Áp dụng ĐLBTKL ta tính được khối lượng muối theo cách tổng quát sau :
mmuối = m KL + m HCl – m H2 = 11,9+ 0,8.36,5 - 0,4.2 = 40,3 (gam)
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 12 Bài 33: Hợp kim của sắt (chính xác nhất)
- Giải SBT Hóa học 12 Bài 7: Luyện tập: Cấu tạo và tính chất của cacbohiđrat (chính xác nhất)
- Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
- Giải SBT Hóa học 12 Bài 13: Đại cương về polime (chính xác nhất)
- Giải SBT Hóa học 12 Bài 1: Este (chính xác nhất)
- Giải SBT Hóa học 12 Bài 6: Saccarozơ, tinh bột và xenlulozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 5: Glucozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 34: Crom và hợp chất của crom (chính xác nhất)