Giải SBT Hóa học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm (Chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 12 Bài 25 SBT: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Bài 25.1 trang 54 Sách bài tập Hóa học 12:
Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của
A. điện tích hạt nhân nguyên tử.
B. khối lượng riêng.
C. nhiệt độ sôi.
D. số oxi hoá.
Lời giải:
A
Bài 25.2 trang 54 Sách bài tập Hóa học 12:
Cho 3 g hỗn hợp gồm Na và kim loại kiềm M tác dụng với nước. Để trung hoà dung dịch thu được cần 800 ml dung dịch HCl 0,25M. Kim loại M là
A. Li. B. Cs.
C. K. D. Rb.
Lời giải:
A
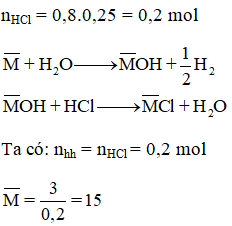
⇒ 2 kim loại là Li(M = 7) và Na (M = 23)
Bài 25.3 trang 54 Sách bài tập Hóa học 12:
Cho 4,7 g K2O vào 195,3 g nước. Nồng độ phần trăm của dưng dịch thu được là
A. 2,6%. B. 6,2%.
C. 2,8%. D. 8,2%.
Lời giải:
C
Bài 25.4 trang 54 Sách bài tập Hóa học 12:
Cho 17 g hỗn hợp X gồm hai kim loại kiềm đứng kế tiếp nhau trong nhóm IA tác dụng với nước thu đừợc 6,72 lít H2 (đktc) và dung dịch Y.
a) Hỗn hợp X gồm
A. Li và Na. B. Na và K.
C. K và Rb. D. Rb và Cs.
b) Thể tích dung dịch HCl 2M cần để trung hoà dung dịch Y là
A. 200 ml. B. 250 ml.
C. 300 ml. D. 350 ml.
Lời giải:
B
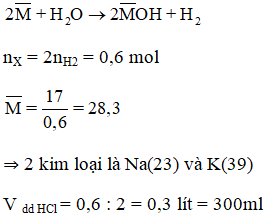
Bài 25.5 trang 55 Sách bài tập Hóa học 12:
Cho 3,9 g kali tác dụng với nước thu được 100 ml dung dịch. Nồng độ mol của dung dịch KOH thu được là
A. 0,1M. B. 0,5M.
C. 1M. D. 0,75M.
Lời giải:
C
K + H2O → KOH + ½ H2
nKOH = nK = 3,9 : 39 = 0,1 mol
CM = 0,1 : 0,1 = 1M
Bài 25.6 trang 55 Sách bài tập Hóa học 12:
Cho hỗn hợp Na và Mg lấy dư vào 100 g dung dịch H2SO4 20% thì thể tích khí H2 (đktc) thoát ra là
A. 4,57 lít. B. 54,35 lít.
C. 49,78 lít. D. 57,35 lít.
Lời giải:
B

Bài 25.7 trang 55 Sách bài tập Hóa học 12:
Điện phân nóng chảy muối clorua của một kim loại kiém thu được 0,896 lít khí (đktc) ở anot và 1,84 g kim loại ở catot. Công thức hoá học của muối là
A. LiCl. B. NaCl.
C. KCl. D. RbCl.
Lời giải:
B
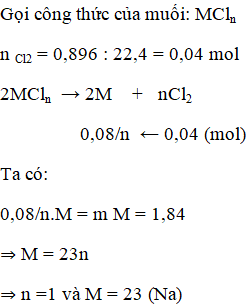
Bài 25.8 trang 55 Sách bài tập Hóa học 12:
Cho 1,36 gam hỗn hợp 2 kim loại kiềm kế tiếp nhau trong nhóm IA tác dụng hết với nước thu được 0,56 lít khí H2 (đktc). Đó là 2 kim loại nào sau đây ?
A. Na, K. B. Rb, Cs. C. K, Rb. D. Li, Na.
Lời giải:
A
Gọi công thức của 2 kim loại là M
2M + 2H2O → 2MOH + H2
nM = 2nH2 = 0,05 mol
⇒ M = 1,36 : 0,05 = 27,2
⇒ 2 kim loại là: Na(23); K (39)
Bài 25.9 trang 55 Sách bài tập Hóa học 12:
Cho a mol CO2 vào dung dịch chứa b mol NaOH, thu được dung dịch X. Dung dịch X vừa tác dụng được với HC1 vừa tác dụng được với KOH. Quan hệ giữa a và b là
A. a > b. B. b > 2a
C. a = b. D. b < 2a.
Lời giải:
D
Do dung dịch X vừa tác dụng với HCl, vừa tác dụng với KOH ⇒ Dung dịch X chưa muối NaHCO3
⇒ nNaOH : nCO2 < 2 ⇒ b < 2a
Bài 25.10 trang 55 Sách bài tập Hóa học 12:
Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được khí X và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện m gam kết tủa. Biểu thức liên hộ giữa m với a và b là
A. m = 100(2b - a) B. m = 56(2a - b).
C. m = 100(a - b). D. m = 197(a + b).
Lời giải:
A
Cho từ từ dung dịch HCl vào dung dịch Na2CO3, có khí CO2 thoát ra nên sau khi tạo muối HCO3- ,HCl dư tác dụng với HCO3- tạo ra khí. Khi cho Ca(OH)2 vào dung dịch Y xuất hiện kết tủa ⇒ Dung dịch Y vẫn còn HCO3- (H+ chỉ tác dụng với 1 phần HCO3 sinh ra để tạo khí, sau đó H+ hết)
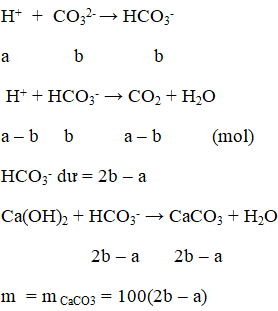
Bài 25.11 trang 56 Sách bài tập Hóa học 12:
Dung dịch NaOH 20% (D = 1,22 g/cm3) có nồng độ của các ion thế nào ? Hãy chọn nồng độ ở cột II để ghép vội ion ở cột I cho phù hợp với dung dịch trên
| Cột I | Cột II |
| a) Nồng độ cation Na+ là: b) Nồng độ anion OH- là: c) Nồng độ cation H+ là: | 1) 0,61M 2) 6,10 M 3) 1,22M 4) 12,20M 5) 0,164.10-14 M |
Lời giải:
Chuyển nồng độ C% sang nồng độ CM của dung dịch NaOH được:
CM= 6,10 M
[Na+] = [OH-] = 6,10M
[H+] = 10-14/[OH-] = 0,164.10-14M
Nối: a - 2; b - 2, c - 5
Bài 25.12 trang 56 Sách bài tập Hóa học 12:
Nhóm kim loại nào sau đây đều là kim loại nhẹ
A. Li, Zn, Fe, Cu B. Mg, Al, Sn, Pb
C. Na, K, Mg, Al D. K, Ba, Ag, Zn
Lời giải:
C
Bài 25.13 trang 56 Sách bài tập Hóa học 12:
Các ion và nguyên tử nào sau đây có cấu hình electron 1s22s22p6?
A. Na+, Mg2+, Al3+, Cl- và Ne
B. Na+, Mg2+, Al3+, Cl- và Ar
C. Na+, Mg2+, Al3+, F- và Ne
D. K+, Ca2+, Cr3+, Br- và
Lời giải:
C
Bài 25.14 trang 56 Sách bài tập Hóa học 12:
Người ta thực hiện các phản ứng sau:
(1) Điện phân NaOH nóng chảy
(2) Điện phân dung dịch NaCl có vách ngăn
(3) Điện phân NaCl nóng chảy
(4) Cho dung dịch NaOH tác dụng với dung dịch HCl
(5) Cho dung dịch NaOH tác dụng với kim loại K.
Phản ứng chuyển ion Na+ thành Na là
A. (1) B. (1), (2) C. (3), (4) D. (1), (3)
Lời giải:
D
Bài 25.15 trang 56 Sách bài tập Hóa học 12:
Công dụng nào sau đây không phải là NaCl
A. Để điều chế kim loại Na
B. Để điều chế Cl2, HCl, nước Gia - ven
C. Khử chua cho đất
D. Làm dịch truyền trong y tế
Lời giải:
C
Bài 25.16 trang 57 Sách bài tập Hóa học 12:
Viết phương trình hoá học của các phản ứng hoàn thành chuỗi chuyển hoá sau :
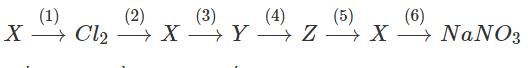
Biết X, Y, Z đều là hợp chất của natri.
Lời giải:
Theo sơ đồ ta có:
X: NaCl Y: NaOH Z: Na2CO3
(1) 2NaCl → 2Na + Cl2
(2) 2Na + Cl2 → 2NaCl
(3) 2NaCl + 2H2O đpdd→ 2NaOH + Cl2 + H2
(4) 2NaOH + CO2 → Na2CO3 + H2O
(5) Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
(6) NaCl + AgNO3 → NaNO3 + AgCl
Bài 25.17 trang 57 Sách bài tập Hóa học 12:
a) Muốn pha 0,5 lít dung dịch NaOH có pH = 12,5 cần phải dùng bao nhiêu gam NaOH ?
b) Để kết tủa hoàn toàn ion Cu2+ trong 200 ml dung dịch CuSO4 có nồng độ 6.10- 3 M cần phải dùng bao nhiêu mililít dung dịch NaOH nói trên ?
Lời giải:
a) 0,63g NaOH
b) 76 ml dung dịch NaOH
Bài 25.18 trang 57 Sách bài tập Hóa học 12:
Nung nóng 7,26 g hỗn hợp gồm NaHCO3 vào Na2CO3, người ta thu được 0,84 lít khí CO2 (đktc).
Hãy xác định khối lượng của mỗi chất có trong hỗn hợp trước và sau khi nung.
Lời giải:
Nung hỗn hợp, chỉ có NaHCO3 bị phân hủy:
2NaHCO3 to→ Na2CO3 + H2O + CO2 (1)
Theo (1), nNaHCO3 = 2nCO2 = 2.0,84/22,4 = 0,075 mol
Trước khi nung:
mNaHCO3 = 84.0,075 = 6,3g
mNa2CO3 = 7,26 - 6,3 = 0,96g
Sau khi nung: mNa2CO3= 0,96+106.0,0375 = 4,935g.
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm (Ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 12 Bài 33: Hợp kim của sắt (chính xác nhất)
- Giải SBT Hóa học 12 Bài 7: Luyện tập: Cấu tạo và tính chất của cacbohiđrat (chính xác nhất)
- Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
- Giải SBT Hóa học 12 Bài 13: Đại cương về polime (chính xác nhất)
- Giải SBT Hóa học 12 Bài 1: Este (chính xác nhất)
- Giải SBT Hóa học 12 Bài 6: Saccarozơ, tinh bột và xenlulozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 5: Glucozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 34: Crom và hợp chất của crom (chính xác nhất)