Giải SBT Hóa học 12 Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng (Chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 12 Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 12 Bài 38 SBT: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng
Bài 38.1 trang 93 Sách bài tập Hóa học 12:
Để phân biệt dung dịch H2S04 đặc, nguội và dung dịch HNO3 đặc, nguội có thể dùng kim loại nào sau đây ?
A. Cr.
B. Al
C. Fe.
D. Cu.
Lời giải:
D
Bài 38.2 trang 93 Sách bài tập Hóa học 12:
Có hai dung dịch axit là HCl và HNO3 đặc, nguội. Kim loại nào sau đây có thể dùng để nhận biết hai dung dịch axịt trên ?
A. Fe B. Al
C. Cr D. Cu
Lời giải:
D
Bài 38.3 trang 93 Sách bài tập Hóa học 12:
Cho kim loại X tác dụng với dung dịch H2SO4 loãng rồi lấy khí thu được để khử oxit kim loại Y. X và Y có thể là
A. đồng và sắt.
B. sắt và đồng.
C. đồng và bạc.
D. bạc và đồng.
Lời giải:
B
Bài 38.4 trang 93 Sách bài tập Hóa học 12:
Cho 9,14 g hợp kim Cu, Mg và Al tác dụng với dung dịch HCl dư thu được khí X và 2,54 g chất rắn Y. Trong hợp kim, khối lượng Al gấp 4,5 lần khối lượng Mg. Thể tích khí X (đktc) là
A. 7,84 lít. B. 5,6 lít
C. 5,8 lít D. 6,2 lít.
Lời giải:
A
2,54g c/rắn Y là Cu ⟹ mAl + mMg = 9,14 – 2,54 = 6,6g
Ta có: mAl = 4,5mMg
⟹ mAl = 5,4g; nMg = 1,2g
Ta có: nH2 = 3/2 nAl + nMg = 0,3 + 0,05 = 0,35 mol
⟹ VX = 7,84 lít
Bài 38.5 trang 93 Sách bài tập Hóa học 12:
Cho 19,2 g Cu vào dung dịch loãng chứa 0,4 mol HNO3, phản ứng xảy ra hoàn toàn thì thể tích khí NO (đktc) thu được là
A. 1,12 lít B. 2,24 lít.
C. 4,48 lít. D. 3,36 lít.
Lời giải:
B
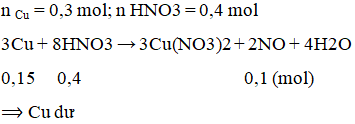
Bài 38.6 trang 94 Sách bài tập Hóa học 12:
Điện phân 200ml dung dịch CuCl2 sau một thời gian người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm một đinh sắt sạch trong dung dịch còn lại sau khi điện phân phản ứng xong thấy khối lượng đinh sắt tăng 1,2g. Nồng độ mol ban đầu của dung dịch CuCl2 là
A. 0,25M B. 1,5M
C. 1,0M D. 0,75M
Lời giải:
C
Ta có: nCl2 = 0,05 mol
⟹ nCuCl2 = 0,05 mol
Vì sau phản ứng ngâm đinh sắt sạch trong dung dịch thấy khối lượng đinh sắt tăng lên ⟹ Cu2+ dư
Cu2+ + Fe → Cu + Fe2+
1 mol Cu2+ tham gia phản ứng làm cho thanh sắt tăng: 64 – 56g = 8g
Khối lượng thanh sắt tăng 1,2g ⟹ nCu2+ = 1,2.1/8 = 0,15 mol
⟹ nCuCl2 = 0,05 + 0,15 = 0,2 mol
CM CuCl2 = 0,2 : 0,2 = 1M
Bài 38.7 trang 94 Sách bài tập Hóa học 12:
Viết PTHH hoàn thành chuỗi biến hoá sau :
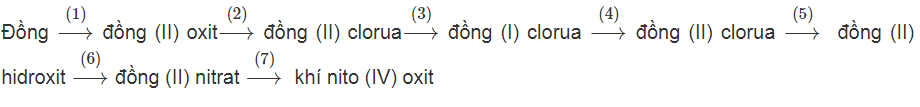
Lời giải:
(1) Cu + O2 to→ 2CuO
(2) CuO + 2HCl → CuCl2 + H2O
(3) CuCl2 + Cu → 2CuCl
(4) 2CuCl + Cl2 to→ 2CuCl2
(5) CuCl2 + NaOH → Cu(OH)2 ↓+ 2NaCl
(6) Cu(OH)2 + 2HNO3→ Cu(NO3)2 + 2H2O
(7) Cu(NO3)2 to→ CuO + 2NO2 + 1/2O2
Bài 38.8 trang 94 Sách bài tập Hóa học 12:
Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và H2S04 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, đktc). Tính V
Lời giải:
Số mol các chất và ion như sau : Cu : 0,05 mol, H+ : 0,12 mol, NO3-: 0,08 mol.
Sử dụng phương trình ion thu gọn, ta có :
3Cu + 8H+ + 2NO3- + 3e → 3Cu2+ + 2NO + 4H2O
H+ phản ứng hết ⟹ nNO = 0,03 (mol).
⟹ VNO = 0,672 (lít)
Bài 38.9 trang 94 Sách bài tập Hóa học 12:
Tính thể tích của dung dịch K2Cr207 0,05M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trong môi trường H2SO4 dư.
Lời giải:
Ta có phương trình phản ứng :
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + K2SO4 + 3Fe2(SO4)3 + 7H2O
0,01 ← 0,06 (mol)
⟹ VK2Cr2O7 = 0,2 lít = 200 (ml)
Bài 38.10 trang 94 Sách bài tập Hóa học 12:
So sánh tính chất lí, hoá học giữa các hợp chất của crom (III) với các hợp chất của nhôm.
Lời giải:
- Tính chất lí học:
| Hợp chất của Cr (III) | Hợp chất của nhôm |
| - Cr2O3: chất rắn, màu lục thẫm, không tan - Cr(OH)3 : kết tủa màu lục xám - Muối Cr(III) hay gặp trong trong phèn crom- kali CrCl3: màu tím; Cr2(SO4)3: màu hồng | - Al2O3: Chất rắn màu trắng, cứng , không tan trong nước - Al(OH)3: Kết tủa keo trắng - Muối nhôm hay gặp trong phèn nhôm |
- Tính chất hóa học:
Các hợp chất của Cr(III) có tính chất lưỡng tính giống như hợp chất của nhôm.
Bài 38.11 trang 94 Sách bài tập Hóa học 12:
Viết phương trình hoá học của các phản ứng trong sơ đồ chuyển hoá sau :
Cr→ Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → NaCrO2
Lời giải:
4Cr + 3O2 to→ 2Cr2O3
Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O
Cr2(SO4)3 + NaOH → Cr(OH)3 + Na2SO4
Cr(OH)3 + NaOH → NaCrO2 + 2H2O.
Bài 38.12 trang 94 Sách bài tập Hóa học 12:
Amoni đicromat khi được nung nóng tạo ra crom(III) oxit, nitơ và nước. Viết phương trình hoá học của phản ứng và cho biết nó thuộc loại phản ứng gì ?
Lời giải:
(NH4)2Cr2O7 to→ Cr2O3 + N2 + 4H2O
Phản ứng thuộc loại phản ứng oxi hoá - khử nội phân tử.
Bài 38.13 trang 94 Sách bài tập Hóa học 12:
Cho 41,4 gam hỗn hợp X gồm Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc (dư), sau phản ứng được chất rắn có khối lượng 16 gam. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm phải dùng 10,8 gam Al. Xác định thành phần % theo khối lượng của Cr2O3 trong hỗn hợp X. Giả thiết các phản ứng đều xảy ra hoàn toàn.
Lời giải:
Chất rắn dư sau phản ứng với kiềm là Fe2O3 ⟹ nFe2O3 = 0,1 mol
Trong phản ứng nhiệt nhôm, chỉ có Fe2O3 và Cr2O3 bị khử. Số mol Al phản ứng là 0,4 mol.
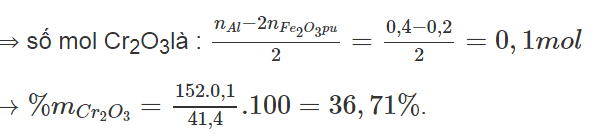
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 12 Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 12 Bài 33: Hợp kim của sắt (chính xác nhất)
- Giải SBT Hóa học 12 Bài 7: Luyện tập: Cấu tạo và tính chất của cacbohiđrat (chính xác nhất)
- Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
- Giải SBT Hóa học 12 Bài 13: Đại cương về polime (chính xác nhất)
- Giải SBT Hóa học 12 Bài 1: Este (chính xác nhất)
- Giải SBT Hóa học 12 Bài 6: Saccarozơ, tinh bột và xenlulozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 5: Glucozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 34: Crom và hợp chất của crom (chính xác nhất)