Giải SBT Hóa học 12 Bài 31: Sắt (chính xác nhất)
Mời các em học sinh và quý thầy cô tham khảo ngay hướng dẫn giải Giải SBT Hóa học 12 Bài 31: Sắt (chính xác nhất) được đội ngũ chuyên gia biên soạn ngắn gọn và đầy đủ dưới đây.
Giải Hóa học 12 Bài 31 SBT: Sắt
Bài 31.1 trang 71 Sách bài tập Hóa học 12:
Fe có số hiệu nguyên tử là 26. Ion Fe3+ có cấu hình electron là
A. [Ar]3d64s2.
B. [Ar]3d6.
C. [Ar]3d34s2
D. [Ar]3d5.
Lời giải:
D
Bài 31.2 trang 71 Sách bài tập Hóa học 12:
Fe có thể tác dụng hết với dung dịch chất nào sau đây ?
A. AlCl3.
B. FeCl3.
C. FeCl2.
D. MgCl2.
Lời giải:
B
Bài 31.3 trang 71 Sách bài tập Hóa học 12:
Cho 1,4 g kim loại X tác dụng với dung dịch HCl thu được dung dịch muối trong đó kim loại có sô oxi hoá +2 và 0,56 lít H2 (đktc). Kim loại X là
A. Mg.
B. Zn.
C. Fe.
D. Ni.
Lời giải:
C
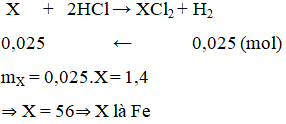
Bài 31.4 trang 71 Sách bài tập Hóa học 12:
Cho m gam Fe tác dụng với dung dịch HNO3 loãng, dư thu được 0,448 lít khí NO duy nhất (đktc). Giá trị của m là
A. 11,2.
B. 1,12.
C. 0,56.
D. 5,60.
Lời giải:
B
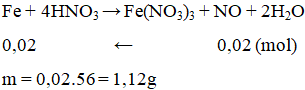
Bài 31.5 trang 71 Sách bài tập Hóa học 12:
Cho 8 g hỗn hợp bột kim loại Mg và Fe tác dụng hết với dung dịch HC1 thấy thoát ra 5,6 lít H2 (đktc). Khối lượng muối tạo ra trong dung dịch là
A. 22,25 g.
B. 22,75 g.
C. 24,45 g.
D. 25,75 g.
Lời giải:
D
nH2 = 0,25 mol ⇒ nH = 0,5 mol
Khi có 0,5 mol nguyên tử H thoát ra thì cũng có 0,5 mol ion Cl- tạo muối
mmuối = mKL + mgốc axit = 8 + 35,5.0,5 = 25,75(g)
Bài 31.6 trang 71 Sách bài tập Hóa học 12:
Cho m gam hỗn hợp Al và Fe phản ứng hoàn toàn với dung dịch HNO3 loãng thu được 2,24 lít NO duy nhất (đktc). Mặt khác cho m gam hỗn hợp này phản ứng với dung dịch HCl thu được 2,80 lít H2 (đktc). Giá trị của m là
A. 8,30.
B. 4,15.
C. 4,50.
D. 6,95.
Lời giải:
B
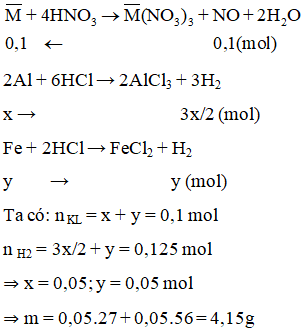
Bài 31.7 trang 72 Sách bài tập Hóa học 12:
Phát biểu nào dưới đây không đúng ?
A. Fe là kim loại chuyển tiếp, thuộc chu kì 4, nhóm VIIIB, ô số 26 trong bảng tuần hoàn.
B. Fe là nguyên tố d, cấu hình electron là [Ar]3d64s2.
C. Khi tạo ra các ion sắt, nguyên tử Fe nhường electron ở phân lớp 3d trước phân lớp 4s.
D. Tương tự nguyên tố Cr, nguyên tử Fe khi tham gia phản ứng không chỉ nhường electron ở phân lớp 4s mà còn có thể nhường thêm electron ở phân lớp 3d.
Lời giải:
C
Bài 31.8 trang 72 Sách bài tập Hóa học 12:
Cấu hình electron nào dưới đây viết đúng ?
A.26Fe : [Ar]4s23d6.
B. 26Fe2+ : [Ar]4s23d4
C. 26Fe2+ : [Ar]3d44s2.
D.26Fe3+ : [Ar]3d5.
Lời giải:
D
Bài 31.9 trang 72 Sách bài tập Hóa học 12:
Nhận định nào dưới đây không đúng ?
A. Fe dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d để trở thành ion Fe3+
B. Fe là kim loại có tính khử trung bình : Fe có thể bị oxi hoá thành Fe2+ hoặc Fe3+.
C. Khi tạo ra các ion Fe, nguyên tử Fe nhường electron ở phân lớp 4s trước phân lớp 3d.
D. Fe là kim loại có tính khử mạnh : Fe có thể bị oxi hoá thành Fe2+ hoặc Fe3+
Lời giải:
D
Bài 31.10 trang 72 Sách bài tập Hóa học 12:
Tính chất đặc biệt của Fe là:
A. nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. dẫn điện yà dẫn nhiệt tốt.
C. kim loại nặng, dẻo, dễ rèn.
D. tính nhiễm từ
Lời giải:
D
Bài 31.11 trang 73 Sách bài tập Hóa học 12:
Phương trình hoá học nào dưới đây viết sai ?
A. 3Fe + 2O2 to→ Fe3O4
B. 2Fe + 3Cl2 → 2FeCl3
C. Fe + 2S to→ FeS2
D. 3Fe + 4H2O to→ Fe3O4 + 4H2
Lời giải:
C
Bài 31.12 trang 73 Sách bài tập Hóa học 12:
Nhận định nào dưới đây không đúng ?
A. Fe khử dễ dàng H+ trong dung dịch HCl, H2SO4 loãng thành H2, Fe bị oxi hoá thành Fe2+.
B. Fe bị oxi hoá bởi HNO3, H2SO4 đặc nóng thành Fe3+.
C. Fe không tác dụng với HNO3 và H2SO4 đặc, nguội.
D. Fe khử được những ion kim loại đứng trước nó trong dãy điện hoá.
Lời giải:
D
Bài 31.13 trang 73 Sách bài tập Hóa học 12:
Fe tác dụng được với dung dịch muối FeCl3 theo phản ứng :Fe + 2FeCl3→ 3FeCl2 là do:
A. mọi kim loại đều có thể tác dụng với dung dịch muối của nó.
B. Fe có thể khử ion Fe3+ xuống ion Fe2+.
C. Ion Fe2+ có tĩnh oxi hoá mạnh hơn ion Fe3+.
D. Ion Fe2+ có tính khử mạnh hơn Fe.
Lời giải:
B
Bài 31.14 trang 73 Sách bài tập Hóa học 12:
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HC1 20% thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24% B. 28,21% C. 15,76% D. 11,79%
Lời giải:
D
Gọi số mol Fe, Mg lần lượt là: x, y ⇒ nHCl pư = 2(x + y)
mdd sau pư = mkl + mdd HCl – mH2
⇒ mdd = 56x + 24y + 73(x+y).100/20 – 2(x+y) = 419x + 387y (g)
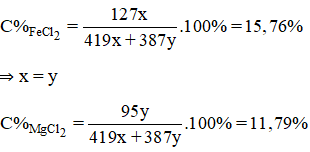
Bài 31.15 trang 73 Sách bài tập Hóa học 12:
Cho các chất sau: (1) Cl2; (2) I2; (3) HNO3; (4) H2SO4 đặc nguội. Khi cho Fe tác dụng với chất nào trong số các chất trên đều tạo được hợp chất trong đó sắt có hóa trị (III)
A. (1), (2) B. (1), (2), (3) C. (1), (3) D. (1), (3), (4)
Lời giải:
D
Bài 31.16 trang 74 Sách bài tập Hóa học 12:
Đốt một kim loại trong bình kín đựng khí clo thu được 32,5 g muối clorua và nhận thấy thể tích khí clo trong bình giảm 6,72 lít (đktc). Hãy xác định tên của kim loại đã dùng.
Lời giải:
Gọi kim loại là M, có hoá trị n.
2M + nCl2 → 2MCln
Theo phương trình hoá học, cứ :
n mol Cl2 thu được 2 mol muối
Vậy 6,72/22,4 = 0,3 mol Cl2 thu được 32,5/(M +32,5n) muối
Do đó ta có : n. 32,5/(M +32,5n) = 2.0,3 → M = 56n/3
Vì n là số nguyên, dương nên chỉ có n = 3 và M = 56 là hợp lí. Vậy kim loại đã dùng là Fe.
Bài 31.17 trang 74 Sách bài tập Hóa học 12:
Sắt tác dụng như thế nào với dung dịch đặc và loãng của các axit HCl, H2SO4, HNO3 ở nhiệt độ thường và nhiệt độ cao ? Viết phương trình hoá học của các phản ứng.
Lời giải:
Fe + 2HCl(l) → FeCl2 + H2
2Fe + 3H2SO4(l) → Fe2(SO4)3 + 3H2
2Fe + 6H2SO4 to→ Fe2(SO4)3 + 6SO2 + 3H2O
Fe + H2SO4 (đ, nguội) → không phản ứng
Fe + 4HNO3 (l) → Fe(NO3)3 + NO + 2H2O
Fe + HNO3 (đ, nguội) → không phản ứng
Fe + HNO3 (đ) to→ Fe(NO3)3 + 3NO2 + 3H2O
Bài 31.18 trang 74 Sách bài tập Hóa học 12:
Đốt nóng một lượng bột sắt trong bình đựng khí O2, sau đó để nguội và cho vào bình một lượng dư dung dịch HCl. Viết phương trình hoá học của các phản ứng có thể xảy ra
Lời giải:
Đốt Fe trong khí O2, sản phẩm có thể là FeO, Fe3 O4 , Fe2O3 và Fe (dư).
Cho dd HCl vào có các phản ứng:
FeO + 2HCl → FeCl2 + H2O
Fe + 2HCl(l) → FeCl2 + H2
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + H2O
Fe2O3 + 6HCl → 2FeCl2 + 3H2O
Fe + 2FeCl3 → 3FeCl2
Bài 31.19 trang 74 Sách bài tập Hóa học 12:
Cho 3,04 g hỗn hợp bột kim loại sắt và đồng tác dụng hết với dung dịch HNO3 loãng, thu được 0,896 lít khí NO duy nhất (đktc). Xác định thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp.
Lời giải:
Fe+ 4HNO3 (l) → Fe(NO3)3 + NO + 2H2O (1)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2)
Đặt x và y la số mol Fe và Cu trong hỗn hợp ta có hệ pt:
56x + 64y = 3,04
x + 2y/3 = 0,04
→ x= 0,02 , y= 0,03
%mFe = 56.0,02/3,04 . 100% = 36,8%
%m Cu = 100 – 36,8= 63,2%.
Bài 31.20 trang 74 Sách bài tập Hóa học 12:
Hoà tan 4 gam một đinh sắt đã bị gỉ trong dung dịch H2SO4 loãng, dư tách bỏ phần không tan được dung dịch A. Dung dịch A này phản ứng vừa hêt với 100 ml dung dịch KMnO4 0,1M. Tính % tạp chất trong đinh sắt giả sử gỉ sắt không phản ứng với dung dịch axit.
Lời giải:
Giả sử phần oxit không phản ứng, vậy chỉ có sắt nguyên chất phản ứng, thứ tự phản ứng như sau :
Fe H2SO4→ Fe2+
phương trình cho - nhận e :
Fe2+ → Fe3+ + le Mn7+O4- + 5e → Mn2+
Số mol KMnO4 là 0,01mol ⟹ n Fe3+ = 0,05
⟹ nFe = nFe2+ = nFe3+ = 0,05 (mol)
⟹ nFe = 56.0,05 = 2,8 (gam) ⟹ m tạp chất = 1,2 (gam)
=> % tạp chất = 1,2/4 . 100% = 30%
Bài 31.21 trang 74 Sách bài tập Hóa học 12:
Cho Fe tác dụng với dung dịch HNO3 thấy sinh ra hỗn hợp khí gồm 0,03 mol NO2 và 0,02 mol NO. Xác định khối lượng Fe đã phản ứng.
Lời giải:
Sử dụng phương trình cho - nhận e và áp dụng ĐLBTĐT, ta có :
Fe→ Fe3+ + 3e
0,03 ← 0,09
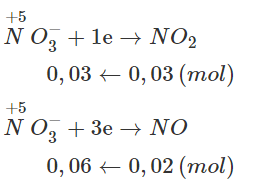
⟹ Khối lượng Fe phản ứng : mFe = 1,68 (g).
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về Giải SBT Hóa 12 Bài 31: Sắt (ngắn gọn nhất) file PDF hoàn toàn miễn phí.
- Giải SBT Hóa học 12 Bài 33: Hợp kim của sắt (chính xác nhất)
- Giải SBT Hóa học 12 Bài 7: Luyện tập: Cấu tạo và tính chất của cacbohiđrat (chính xác nhất)
- Giải SBT Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (chính xác nhất)
- Giải SBT Hóa học 12 Bài 13: Đại cương về polime (chính xác nhất)
- Giải SBT Hóa học 12 Bài 1: Este (chính xác nhất)
- Giải SBT Hóa học 12 Bài 6: Saccarozơ, tinh bột và xenlulozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 5: Glucozơ (chính xác nhất)
- Giải SBT Hóa học 12 Bài 34: Crom và hợp chất của crom (chính xác nhất)